
Vlastnosti, použití a příklady halogenovaných derivátů

The halogenované deriváty jsou všechny ty sloučeniny, které mají atom halogenu; tj. kterýkoli z prvků skupiny 17 (F, Cl, Br, I). Tyto prvky se liší od ostatních tím, že jsou více elektronegativní a vytvářejí rozmanitost anorganických a organických halogenidů..
Obrázek níže ukazuje plynné molekuly halogenů. Shora dolů: fluor (Fdva), chlor (Cldva), brom (Brdva) a jód (Idva). Každý z nich má schopnost reagovat s drtivou většinou prvků, dokonce i mezi kongenery stejné skupiny (interhalogeny).
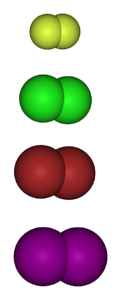
Halogenované deriváty tedy mají vzorec MX, pokud jde o halogenid kovu, RX, pokud jde o alkyl, a ArX, pokud jsou aromatické. Poslední dva jsou v kategorii organických halogenidů. Stabilita těchto sloučenin vyžaduje energetický „přínos“ ve srovnání s původní molekulou plynu.
Obecně platí, že fluor tvoří stabilnější halogenované deriváty než jód. Důvodem jsou rozdíly mezi jejich atomovými poloměry (fialové koule jsou objemnější než žluté).
Jak se zvyšuje atomový poloměr, překrývání orbitalů mezi halogenem a druhým atomem je horší, a proto je vazba slabší..
Rejstřík článků
- 1 Názvosloví
- 1.1 Anorganické látky
- 1.2 Organické
- 2 Vlastnosti
- 2.1 Anorganické halogenidy
- 2.2 Organické halogenidy
- 3 použití
- 4 Další příklady
- 5 Reference
Nomenklatura
Správný způsob pojmenování těchto sloučenin závisí na tom, zda jsou anorganické nebo organické..
Anorganické
Halogenidy kovů se skládají z vazby, iontové nebo kovalentní, mezi halogenem X a kovem M (ze skupin 1 a 2, přechodné kovy, těžké kovy atd.).
V těchto sloučeninách mají všechny halogeny oxidační stav -1. Proč? Protože jeho nastavení valence je nsdvanp5.
Proto potřebují k získání valenčního oktetu získat pouze jeden elektron, zatímco kovy oxidují a dávají jim elektrony, které mají k dispozici..
Fluor tedy zůstává jako F-, fluorid; Cl-, chlorid; BR-, bromid; a já-, Já vydržím. Název MF by měl být: (název kovu) fluorid (n), kde n je valence kovu, pouze pokud má více než jeden. V případě kovů skupin 1 a 2 není nutné jmenovat valenci.
Příklady
- NaF: fluorid sodný.
- CaCldva: chlorid vápenatý.
- AgBr: bromid stříbrný.
- ZnIdva: jodid zinečnatý.
- CuCl: chlorid měďnatý.
- CuCldva: chlorid měďnatý.
- TiCl4: chlorid titaničitý nebo chlorid titaničitý.
Vodík a nekovové prvky - dokonce i samotné halogeny - však mohou také tvořit halogenidy. V těchto případech není valence nekovu na konci pojmenována:
- PCl5: chlorid fosforečný.
- BF3: fluorid boritý.
- Ali3: trijodid hlinitý.
- HBr: bromovodík.
- LI7: jod heptafluorid.
Organické
Bez ohledu na to, zda se jedná o RX nebo ArX, je halogen kovalentně vázán na atom uhlíku. V těchto případech jsou halogeny uváděny jejich jmény a zbytek nomenklatury závisí na molekulární struktuře R nebo Ar.
Pro nejjednodušší organickou molekulu je metan (CH4), následující deriváty se získají nahrazením H za Cl:
- CH3Cl: chlormethan.
- CHdvaCldva: dichlormethan.
- CHCI3: trichlormethan (chloroform).
- CCl4: tetrachlormethan (chlorid uhličitý nebo tetrachlormethan).
Zde R se skládá z jediného atomu uhlíku. U ostatních alifatických řetězců (lineárních nebo rozvětvených) se tedy počítá počet atomů uhlíku, z nichž je vázán na halogen:
CH3CHdvaCHdvaF: 1-fluorpropan.
Výše uvedený příklad byl příkladem primárního alkylhalogenidu. V případě, že je řetězec rozvětvený, je vybrán nejdelší řetězec obsahující halogen a začíná počítání, přičemž je ponechán nejmenší možný počet:
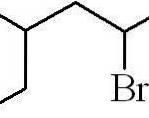
3-methyl-5-bromhexan
Totéž se děje s dalšími substituenty. Podobně je pro aromatické halogenidy pojmenován halogen a poté zbytek struktury:
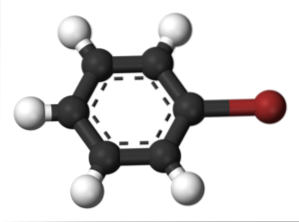
Horní obrázek ukazuje sloučeninu zvanou brombenzen, zvýrazňující atom bromu hnědou barvou.
Vlastnosti
Anorganické halogenidy
Anorganické halogenidy jsou iontové nebo molekulární pevné látky, i když první jsou hojnější. V závislosti na interakcích a iontových poloměrech MX bude rozpustný ve vodě nebo jiných méně polárních rozpouštědlech.
Nekovové halogenidy (například halogenidy boru) jsou obecně Lewisovy kyseliny, což znamená, že přijímají elektrony za vzniku komplexů. Na druhé straně halogenovodíky (nebo halogenidy) rozpuštěné ve vodě produkují takzvané hydracidy..
Jeho body tání, varu nebo sublimace padají na elektrostatické nebo kovalentní interakce mezi kovem nebo nekovem s halogenem..
Iontové poloměry rovněž hrají v těchto vlastnostech důležitou roli. Například pokud M+ a X- mají podobné velikosti, vaše krystaly budou stabilnější.
Organické halogenidy
Jsou polární. Proč? Protože rozdíl v elektronegativitách mezi C a halogenem vytváří v molekule permanentní polární moment. Podobně to klesá, když skupina 17 klesá, z vazby C-F na C-I.
Bez ohledu na molekulární strukturu R nebo Ar, rostoucí počet halogenů přímo ovlivňuje teploty varu, protože zvyšují molární hmotnost a intermolekulární interakce (RC-X-X-CR). Většina z nich je nemísitelná s vodou, ale může se rozpouštět v organických rozpouštědlech.
Aplikace
Použití halogenovaných derivátů si může rezervovat vlastní text. Molekulární „partneři“ halogenů jsou klíčovým faktorem, protože jejich vlastnosti a reaktivita definují použití derivátu..
Mezi velkou rozmanitostí možných použití tak vyniká:
- Molekulární halogeny se používají k výrobě halogenových žárovek, kde dochází ke kontaktu s žárovkovým wolframovým vláknem. Účelem této směsi je reagovat halogen X s odpařeným wolframem. Tímto způsobem je zabráněno jeho usazování na povrchu baňky, což zaručuje delší životnost..
- Fluoridové soli se používají při fluoridaci vody a zubních past.
- Chlornany sodné a vápenaté jsou dvě aktivní látky v komerčních bělících roztocích (chlor)..
- Přestože chlorfluoruhlovodíky (CFC) poškozují ozonovou vrstvu, používají se v aerosolech a chladicích systémech..
- Vinylchlorid (CHdva= CHCl) je monomer polymeru polyvinylchloridu (PVC). Na druhé straně se teflon, používaný jako nepřilnavý materiál, skládá z polymerních řetězců tetrafluorethylenu (FdvaC = CFdva).
- Používají se v analytické chemii a v organických syntézách pro různé účely; mezi nimi je syntéza léků.
Další příklady
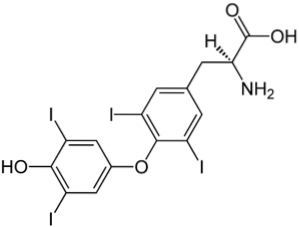
Horní obrázek ilustruje hormon štítné žlázy, který je zodpovědný za produkci tepla i za zvýšení celkového metabolismu v těle. Tato sloučenina je příkladem halogenovaného derivátu přítomného v lidském těle.
Mezi další halogenované sloučeniny patří:
- Dichlorodifenyltrichlorethan (DDT), účinný insekticid, ale se závažnými dopady na životní prostředí.
- Chlorid cínatý (SnCldva), používaný jako redukční činidlo.
- Chlorethan nebo 1-chlorethan (CH3CHdvaCl), lokální anestetikum, které rychle působí ochlazením pokožky.
- Dichlorethylen (ClCH = CCIH) a tetrachlorethylen (CldvaC = CCldva), který se používá jako rozpouštědla v průmyslu chemického čištění.
Reference
- Dr. Ian Hunt. Základní organická nomenklatura IUPAC Haloalkany / alkylhalogenidy. Citováno dne 4. května 2018 z: chem.ucalgary.ca
- Richard C. Banks. (Srpen 2000). Nomenklatura organických halogenidů. Citováno dne 4. května 2018 z: chemistry.boisestate.edu
- Advameg, Inc. (2018). Organické halogenové sloučeniny. Citováno dne 4. května 2018 z: chemistryexplained.com
- Organické halogenové sloučeniny. Citováno dne 4. května 2018 z: 4college.co.uk
- Dr. Seham Alternativní. (2014). Organické halogenové sloučeniny. Citováno dne 4. května 2018 od: fac.ksu.edu.sa
- Clark J. Fyzikální vlastnosti alkylhalogenidů. Citováno dne 4. května 2018 z: chem.libretexts.org
- Dr. Manal K. Rasheed. Organické halogenidy. Citováno dne 4. května 2018 z: comed.uobaghdad.edu.iq



Zatím žádné komentáře