
Charakteristiky polovodičového stavu, vlastnosti, typy, příklady

The pevné skupenství je to jeden z hlavních způsobů přidávání hmoty k vytváření kondenzovaných nebo pevných těles. Celá zemská kůra, opouštějící moře a oceány, je pestrý konglomerát pevných látek. Příklady předmětů v pevném stavu jsou kniha, kámen nebo zrnka písku.
Můžeme interagovat s pevnými látkami díky odpuzování našich elektronů od atomů nebo molekul. Na rozdíl od kapalin a plynů, pokud nejsou silně toxické, naše ruce jimi nemohou projít, ale rozpadat se nebo je absorbovat.

S pevnými látkami se obecně manipuluje nebo je snáze manipuluje než s kapalinou nebo plynem. Pokud nejsou jeho částice jemně rozděleny, nebude jej větrný proud přenášet jinými směry; jsou fixovány v prostoru definovaném mezimolekulárními interakcemi jejich atomů, iontů nebo molekul.
Rejstřík článků
- 1 Koncept pevných látek
- 2 Obecná charakteristika pevných látek
- 3 Vlastnosti
- 3.1 Body tání
- 3.2 Stechiometrie
- 3.3 Vady
- 3.4 Reaktivita
- 3.5 Fyzické
- 4 Typy a příklady
- 4.1 Krystalické pevné látky
- 4.2 Amorfní pevné látky
- 4.3 Iontový
- 4.4 Kovové
- 4.5 Atomová
- 4.6 Molekulární a polymerní
- 4.7 Kovalentní sítě
- 5 Reference
Solidní koncept
Pevná látka je stav hmoty, ve kterém existuje tuhý objem a tvar; částice, které tvoří materiály nebo předměty v pevném stavu, jsou fixovány na jednom místě, nejsou snadno stlačitelné.
Tento stav hmoty je nejrozmanitější a nejbohatší z hlediska chemie a fyziky. Máme iontové, kovové, atomové, molekulární a kovalentní pevné látky, každá s vlastní strukturní jednotkou; tj. s vlastními krystaly. Když jim jejich způsob agregace neumožňuje vytvořit řádné vnitřní struktury, stanou se amorfními a složitými.
Studium pevného stavu konverguje v konstrukci a syntéze nových materiálů. Například dřevo, přírodní masiv, se také používá jako ozdobný materiál a pro stavbu domů.
Jiné pevné materiály umožňují výrobu automobilů, letadel, lodí, kosmických lodí, jaderných reaktorů, sportovních potřeb, baterií, katalyzátorů a mnoha dalších předmětů nebo produktů..
Obecná charakteristika pevných látek

Hlavní charakteristiky pevných látek jsou:
-Mají určitou hmotnost, objem a tvary. Například plyn nemá konec nebo začátek, protože závisí na kontejneru, který jej ukládá..
-Jsou velmi husté. Pevné látky bývají hustší než kapaliny a plyny; i když z pravidla existuje několik výjimek, zejména při porovnávání kapalin a pevných látek.
-Vzdálenosti, které oddělují jejich částice, jsou krátké. To znamená, že byly velmi soudržné nebo zhutněné ve svém příslušném objemu.

-Jejich intermolekulární interakce jsou velmi silné, jinak by neexistovaly jako takové a v pozemských podmínkách by se roztavily nebo sublimovaly..

-Mobilita pevných látek je obvykle poměrně omezená, a to nejen z hlediska materiálu, ale také z hlediska molekulárního. Jeho částice jsou omezeny na pevnou pozici, kde mohou pouze vibrovat, ale nepohybovat se a neotáčet (teoreticky).
Vlastnosti
Body tání
Všechny pevné látky, pokud se v procesu nerozloží, a bez ohledu na to, zda jsou dobrými vodiči tepla, mohou při určité teplotě projít do kapalného stavu: jejich teplota tání. Když je dosaženo této teploty, její částice nakonec zvládnou proudit a unikat ze svých pevných pozic..
Tato teplota tání bude záviset na povaze pevné látky, jejích interakcích, molární hmotnosti a energii krystalické mřížky. Obecně platí, že iontové pevné látky a kovalentní sítě (jako je diamant a oxid křemičitý) mají obvykle nejvyšší teploty tání; zatímco molekulární pevné látky, nejnižší.
Následující obrázek ukazuje, jak se kostka ledu (pevná fáze) změní na kapalnou:

Stechiometrie
Velká část pevných látek je molekulárních, protože se jedná o sloučeniny, jejichž intermolekulární interakce jim umožňují spojit se takovým způsobem. Mnoho dalších je však iontových nebo částečně iontových, takže jejich jednotkami nejsou molekuly, ale buňky: soubor atomů nebo iontů uspořádaných uspořádaným způsobem..
Právě zde musí vzorce těchto pevných látek respektovat neutralitu nábojů, což naznačuje jejich složení a stechiometrické vztahy. Například těleso, jehož hypotetický vzorec je AdvaB4NEBOdva poukazuje na to, že má stejný počet atomů A jako O (2: 2), zatímco má dvojnásobný počet atomů B (2: 4).
Všimněte si, že indexy vzorce AdvaB4NEBOdva jsou to celá čísla, což ukazuje, že se jedná o stechiometrickou pevnou látku. Složení mnoha pevných látek je popsáno v těchto vzorcích. Poplatky A, B a O se musí přidat rovné nule, protože jinak by došlo k kladnému nebo zápornému náboji.
U pevných látek je obzvláště užitečné vědět, jak interpretovat jejich vzorce, protože složení kapalin a plynů je obecně jednodušší.
Vady
Struktury pevných látek nejsou dokonalé; představují nedokonalosti nebo vady, i když mohou být krystalické. U kapalin nebo plynů tomu tak není. Neexistují žádné oblasti kapalné vody, které by bylo možné předem potvrdit a které by byly „dislokovány“ s ohledem na své okolí..
Takové vady jsou odpovědné za to, že pevné látky jsou tvrdé a křehké, vykazují vlastnosti, jako je pyroelektřina a piezoelektřina, nebo přestávají mít definované složení; to znamená, že jsou nestechiometrické pevné látky (například A0,4B1.3NEBO0,5).
Reaktivita
Pevné látky jsou obvykle méně reaktivní než kapaliny a plyny; ale ne kvůli chemickým příčinám, ale kvůli skutečnosti, že jejich struktury zabraňují reaktantům v útoku na částice uvnitř nich, přičemž nejprve reagují s částicemi na jejich povrchu. Proto reakce zahrnující pevné látky bývají pomalejší; pokud nejsou rozmělněny na prášek.
Když je pevná látka ve formě prášku, její menší částice mají větší plochu nebo povrch, aby mohly reagovat. Proto jsou jemné pevné látky často označovány jako potenciálně nebezpečná činidla, protože se mohou rychle vznítit nebo prudce reagovat při kontaktu s jinými látkami nebo sloučeninami..
Pevné látky se často rozpouštějí v reakčním prostředí, aby se systém homogenizoval a provedla se syntéza s vyšším výtěžkem..
Fyzický
S výjimkou bodu tání a defektů odpovídá dosud řečeno více chemickým vlastnostem pevných látek než jejich fyzikálním vlastnostem. Fyzika materiálů je hluboce zaměřena na to, jak světlo, zvuk, elektrony a teplo interagují s pevnými látkami, ať už jsou krystalické, amorfní, molekulární atd..
Zde vstupuje to, co je známé jako plastové, elastické, tuhé, neprůhledné, průhledné, supravodivé, fotoelektrické, mikroporézní, feromagnetické, izolační nebo polovodičové pevné látky..
V chemii jsou zajímavé například materiály, které neabsorbují ultrafialové záření ani viditelné světlo, protože se používají k výrobě měřících cel pro UV-Vis spektrofotometry. Totéž se děje s infračerveným zářením, když chcete charakterizovat sloučeninu získáním jejího IR spektra nebo studovat postup reakce.
Studium a manipulace se všemi fyzikálními vlastnostmi pevných látek vyžaduje enormní odhodlání, stejně jako jejich syntézu a design, výběr „kousků“ anorganické, biologické, organické nebo organokovové konstrukce pro nové materiály.
Typy a příklady
Protože existuje několik druhů pevných látek chemicky, budou pro každý z nich uvedeny samostatné příklady..
Krystalické pevné látky
Na jedné straně jsou krystalické pevné látky. Tyto prvky se vyznačují tím, že molekuly, které je tvoří, jsou konfigurovány stejným způsobem, který se opakuje jako vzor v celém krystalu. Každý vzor se nazývá jednotková buňka.
Krystalické pevné látky se také vyznačují tím, že mají definovanou teplotu tání; To znamená, že vzhledem k uniformitě uspořádání jeho molekul existuje stejná vzdálenost mezi každou jednotkovou buňkou, což umožňuje, aby se celá struktura neustále transformovala při stejné teplotě..
Příklady krystalických pevných látek mohou být sůl a cukr..
Amorfní pevné látky
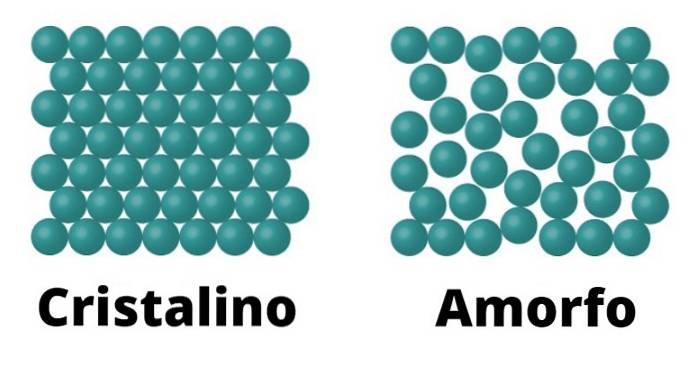
Amorfní pevné látky se vyznačují tím, že konformace jejich molekul nereaguje na vzorec, ale spíše se mění po celém povrchu.
Protože takový vzorec neexistuje, není teplota tání amorfních pevných látek definována, na rozdíl od krystalických, což znamená, že se taje postupně a za různých teplot..
Příkladem amorfních pevných látek může být sklo a většina plastů.
Ionics
Iontové pevné látky se vyznačují tím, že mají kationty a anionty, které spolu interagují elektrostatickou přitažlivostí (iontová vazba). Když jsou ionty malé, jsou výsledné struktury obvykle vždy krystalické (s přihlédnutím k jejich defektům). Mezi některými iontovými pevnými látkami máme:
-NaCl (Na+Cl-), chlorid sodný
-MgO (Mgdva+NEBOdva-), oxid hořečnatý
-Zloděj3 (ACdva+CO3dva-), uhličitan vápenatý
-KURS4 (Cudva+SW4dva-), síran měďnatý
-KF (K.+F-), fluorid draselný
-NH4Cl (NH4+Cl-), chlorid amonný
-ZnS (Zndva+Sdva-), sulfid zinečnatý
-Fe (C.6H5VRKAT)3, benzoát železa
Kovový
Jak naznačuje jejich název, jsou to pevné látky, které mají kovové atomy interagující prostřednictvím kovové vazby:
-stříbrný
-Zlato
-Vést
-Mosaz
-Bronz
-bílé zlato
-Cín
-Oceli
-Dural
Všimněte si, že slitiny se také evidentně počítají jako kovové pevné látky.
Atomový
Kovové pevné látky jsou také atomové, protože teoreticky neexistují žádné kovalentní vazby mezi kovovými atomy (M-M). Ušlechtilé plyny se však v podstatě považují za atomové druhy, protože mezi nimi převládají pouze londýnské disperzní síly..
Proto, ačkoli to nejsou pevné látky s vysokou aplikací (a je obtížné je získat), jsou krystalizované vzácné plyny příklady atomových pevných látek; tj .: helium, neon, argon, krypton atd., pevné látky.
Molekulární a polymerní
Molekuly mohou interagovat prostřednictvím Van der Wallsových sil, kde jejich molekulové hmotnosti, dipólové momenty, vodíkové vazby, struktury a geometrie hrají důležitou roli. Čím silnější jsou tyto interakce, tím je pravděpodobnější, že budou ve formě pevné látky.
Na druhou stranu, stejná úvaha platí pro polymery, které jsou díky své vysoké průměrné molekulové hmotnosti téměř vždy pevné látky a několik z nich je amorfních; protože pro jeho polymerní jednotky je obtížné se zařídit, aby vytvořily krystaly.
Mezi některými molekulárními a polymerními pevnými látkami tedy máme následující:
-Suchý led

-Cukr
-Jód
-Kyselina benzoová
-Acetamid
-Kosočtverečná síra
-Kyselina palmitová
-Fullereny
-Zápas
-Kofein
-Naftalen
-Dřevo a papír
-Hedvábí
-Teflon
-Polyethylen
-Kevlar
-Bakelit
-Polyvinyl chlorid
-Polystyren
-Polypropylen
-Protein
-Tabulka čokolády
Kovalentní sítě
Konečně máme kovalentní sítě mezi nejtvrdšími a nejvyššími teplotami tání pevných látek. Některé příklady jsou:
-Grafit
-diamant
-Křemen
-Karbid křemíku
-Nitrid boru
-Fosfid hlinitý
-Gallium arsenid
Reference
- Shiver & Atkins. (2008). Anorganická chemie. (Čtvrté vydání). Mc Graw Hill.
- Whitten, Davis, Peck a Stanley. (2008). Chemie. (8. vydání). Učení CENGAGE.
- Wikipedia. (2019). Chemie pevných látek. Obnoveno z: en.wikipedia.org
- Elsevier B.V. (2019). Chemie pevných látek. ScienceDirect. Obnoveno z: sciencedirect.com
- Dr. Michael Lufaso. (s.f.). Poznámky k přednášce o chemii pevných látek. Obnoveno z: unf.edu
- askIITians. (2019). Obecné vlastnosti pevného skupenství. Obnoveno z: askiitians.com
- David Wood. (2019). Jak atomy a molekuly tvoří pevné látky: vzory a krystaly. Studie. Obnoveno z: study.com



Zatím žádné komentáře