
Hexokinázové struktury, funkce, formy

The hexokináza (HK) je enzym, který katalyzuje první reakci glykolytické dráhy prakticky ve všech živých organismech, prokaryotech i eukaryotech. Je zodpovědný za přenos fosforylové skupiny na glukózu a produkuje glukózu-6P, i když může také fosforylovat hexosy jiných cukrů (6 atomů uhlíku).
Tento enzym je zařazen do jedné ze dvou rodin enzymů glukózové kinázy (enzymy, které přenášejí fosforylové skupiny na substráty, jako je glukóza): rodina hexokináz (HK), jejíž členové jsou rozděleni do tří různých skupin známých jako skupina HK, skupina A a skupina B.
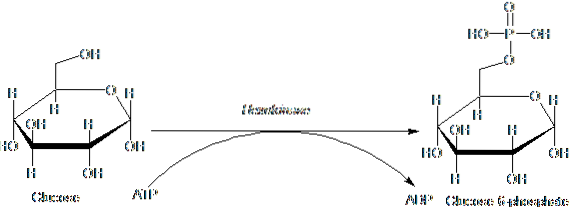
Enzymy patřící do rodiny HK jsou charakterizovány fosforylací glukózy na úkor ATP jako donorové molekuly fosforylové skupiny a její členové se mezi sebou liší hlavně s ohledem na svou molekulovou hmotnost a substrátovou specificitu..
Skupina HK zahrnuje enzymy eukaryotických organismů (ATP: D-hexóza 6-fosfotransferázy), zatímco skupinu A představují enzymy gramnegativních bakterií, sinic, amitochondriátových protistů a trypanosomatidů a skupina B obsahuje enzymy grampozitivní bakterie a krenokontické organismy.
Enzymy skupiny A a B jsou také známé jako glukokinázy (GlcKs), protože jsou schopné výlučně fosforylovat glukózu, a proto se tyto enzymy nazývají ATP: D-glukóza 6-fosfotransferázy.
Jako glykolytický enzym má hexokináza velký metabolický význam, protože bez ní by tato důležitá cesta nebyla možná a buňky vysoce závislé na spotřebě sacharidů, jako jsou mozkové a svalové buňky mnoha savců, by obecně měly vážné funkční a fyziologické překážky..
Rejstřík článků
- 1 Struktura
- 2 funkce
- 2.1 V rostlinách
- 3 tvary
- 4 Odkazy
Struktura
Jak bude vidět později, existují různé typy enzymů hexokinázy u savců a dalších obratlovců (stejně jako u jednobuněčných organismů, jako jsou kvasinky). U savců byly popsány čtyři: izoformy I, II, III a IV.
První tři isozymy mají molekulovou hmotnost 100 kDa, ale izozym IV má 50 kDa. Tyto izoenzymy (zejména I-III) vykazují mezi nimi vysokou sekvenční podobnost s ohledem na jejich C- a N-konce, stejně jako s ostatními členy rodiny hexokináz..
N-terminální doména těchto enzymů je považována za „regulační“ doménu, zatímco katalytická aktivita je prováděna C-terminální doménou (savčí HK II má aktivní místa v obou doménách).
N-terminální doména je spojena s C-terminální doménou prostřednictvím alfa šroubovice, každá má molekulovou hmotnost přibližně 50 kDa a má vazebné místo pro glukózu.
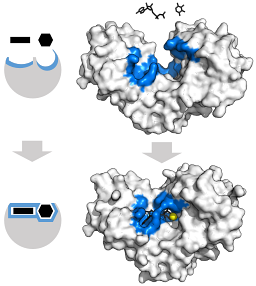
Terciární struktura těchto enzymů je v zásadě složena z β-skládaných listů smíchaných s alfa helixy, jejichž podíl se liší vzhledem k danému enzymu a druhu; vazebné místo pro ATP, druhý substrát pro hexokinázu, se obvykle skládá z pěti β listů a dvou alfa šroubovic.
Funkce
Hexokináza má transcendentální funkci v metabolismu sacharidů většiny živých bytostí, protože katalyzuje první krok glykolytické dráhy a zprostředkovává fosforylaci glukózy uvnitř buňky..
Tento první krok glykolýzy, který spočívá v přenosu fosforylové skupiny z ATP (dárce) na glukózu, čímž se získá 6-fosfát glukózy a ADP, je prvním ze dvou energetických investičních kroků ve formě ATP.
Kromě toho je reakce katalyzovaná hexokinázou krokem „aktivace“ glukózy pro její následné zpracování a představuje krok „závazku“, protože takto fosforylovaná glukóza nemůže opustit buňku pomocí svých konvenčních transportérů v membráně..
Produkt reakce katalyzovaný hexokinázou, tj. 6-fosfát glukózy, je bodem větvení, protože je prvním substrátem používaným v pentózo-fosfátové cestě a při syntéze glykogenu u mnoha zvířat (a škrobu v rostlinách)..
V rostlinách
Funkce hexokinázy v rostlinách se příliš neliší od funkce zvířat nebo mikroorganismů, ve vyšších rostlinách však tento enzym funguje také jako „senzor“ koncentrace cukrů..
Důležitost této funkce v těchto organismech souvisí s účastí cukrů jako regulačních faktorů při expresi genů, které se účastní různých metabolických procesů, jako jsou:
- Fotosyntéza
- Glyoxylátový cyklus
- Dýchání
- Odbourávání nebo syntéza škrobu a sacharózy
- Metabolismus dusíku
- Obrana proti patogenům
- Regulace buněčného cyklu
- Léčivá odpověď
- Pigmentace
- Senescence, mezi ostatními.
Tato funkce hexokinázy jako „senzoru“ množství intracelulární glukózy byla také popsána u kvasinek a savců..
Tvary
V přírodě existují různé formy hexokináz, což závisí zásadně na druhu, o kterém se uvažuje.
Například u lidí a jiných obratlovců byla prokázána existence 4 různých izoforem enzymu hexokinázy v cytosolickém kompartmentu, které byly označeny římskými číslicemi I, II, III a IV.
Isoenzymy I, II a III mají molekulovou hmotnost 100 kDa, jsou inhibovány svým reakčním produktem (glukóza-6-fosfát) a jsou velmi příbuzné glukóze, to znamená, že mají velmi nízkou Km konstantu. Tyto enzymy však mají špatnou substrátovou specificitu a jsou schopné fosforylovat jiné hexózy, jako je fruktóza a manóza.
Isoenzym IV, také známý jako glukokináza (GlcK), má pouze 50 kDa v molekulové hmotnosti a přestože je špatně příbuzný (vysoké hodnoty Km), má vysokou specificitu pro glukózu jako substrát a nepodléhá jim. Regulační mechanismy než další tři izoenzymy.
Glukokináza (izoenzym IV hexokinázy mnoha savců) se nachází hlavně v játrech a pomáhá tomuto orgánu při „úpravě“ rychlosti spotřeby glukózy v reakci na variace tohoto substrátu v cirkulující krvi..
Zdá se, že tři geny, které kódují hexokinázy I, II a III u zvířat, mají stejného předka 50 kDa, který byl duplikován a fúzován v genomu, což se jeví jako evidentní, když se zjistí, že katalytická aktivita forem I a III spočívá pouze C-koncový konec.
Reference
- Aronoff, S.L., Berkowitz, K., Shreiner, B., & Want, L. (2004). Metabolismus a regulace glukózy: kromě inzulínu a glukagonu. Spektrum diabetu, 17(3), 183-190.
- Harrington, G. N., & Bush, D. R. (2003). Bifunkční role hexokinázy v metabolismu a signalizaci glukózy. Rostlinná buňka, patnáct(11), 2493-2496.
- Jang, J. C., León, P., Zhou, L. a Sheen, J. (1997). Hexokináza jako senzor cukru ve vyšších rostlinách. Rostlinná buňka, 9(1), 5-19.
- Kawai, S., Mukai, T., Mori, S., Mikami, B., & Murata, K. (2005). Hypotéza: struktury, evoluce a předchůdce glukózových kináz v rodině hexokináz. Journal of Bioscience and Bioengineering, 99(4), 320 - 330.
- Mathews, K. E. (1998). Van Holde. Biochemie.
- Wilson, J. E. (2003). Izozymy savčích hexokináz: struktura, subcelulární lokalizace a metabolické funkce. Journal of Experimental Biology, 206(12), 2049-2057.


Zatím žádné komentáře