
Periodické vlastnosti prvků a jejich vlastnosti

The Periodické vlastnosti prvků jsou ty, které definují své fyzikální a chemické chování z atomové perspektivy a jejichž velikosti kromě atomového čísla umožňují klasifikaci atomů.
Ze všech vlastností jsou tyto charakterizovány, jak naznačuje jejich název, pro to, že jsou periodické; to znamená, že pokud bude studována periodická tabulka, bude možné potvrdit, že její veličiny odpovídají trendu, který se shoduje a opakuje se s uspořádáním prvků v periodách (řádcích) a skupinách (sloupcích).

Například pokud se prochází periodou a periodická vlastnost klesá s velikostí každého prvku, stane se jí totéž ve všech obdobích. Na druhou stranu, pokud klesání skupiny nebo sloupce zvyšuje jeho velikost, lze očekávat, že se to samé stane i pro ostatní skupiny..
A tak se jeho variace opakují a vykazují jednoduchou tendenci, která souhlasí s uspořádáním prvků podle jejich atomových čísel. Tyto vlastnosti jsou přímo zodpovědné za kovový nebo nekovový charakter prvků, jakož i za jejich reaktivitu, což jim pomohlo zařadit je do větší hloubky..
Pokud by na chvíli nebyla identita prvků známa a byly by považovány za podivné „koule“, mohla by být periodická tabulka přestavěna (se spoustou práce) s využitím těchto vlastností.
Tímto způsobem by předpokládané koule získaly barvy, které by jim umožnily vzájemně se odlišovat ve skupinách (horní obrázek). Znát jejich elektronické vlastnosti, mohly by být uspořádány do období a skupiny by odhalily ty, které mají stejný počet valenčních elektronů.
Učení a uvažování o periodických vlastnostech je stejné jako vědět, proč prvky reagují tak či onak; je vědět, proč jsou kovové prvky v určitých oblastech tabulky a nekovové prvky v jiných.
Rejstřík článků
- 1 Jaké jsou periodické vlastnosti a jejich vlastnosti
- 1,1 - Atomový poloměr
- 1.2 - Elektronegativita
- 1.3 - Kovový charakter
- 1.4 - Ionizační energie
- 1.5 - Elektronická afinita
- 2 Odkazy
Jaké jsou periodické vlastnosti a jejich vlastnosti
-Atomové rádio
Při pozorování koulí na obrázku je první věcí, kterou si můžete všimnout, že nejsou všechny stejně velké. Některé jsou objemnější než jiné. Pokud se podíváte pozorněji, zjistíte, že tyto velikosti se liší podle vzoru: v jednom období se zmenšuje zleva doprava a ve skupině se zvětšuje shora dolů..
Výše uvedené lze také říci takto: atomový poloměr se zmenšuje směrem ke skupinám nebo sloupcům vpravo a zvyšuje se v nižších obdobích nebo řádcích. V tomto případě je atomový poloměr první periodickou vlastností, protože jeho variace se řídí vzorem v prvcích..
Jaderný náboj vs elektrony
Proč tento vzor? V období zaujímají elektrony atomu stejnou energetickou hladinu, která souvisí se vzdáleností, která je odděluje od jádra. Když přecházíme z jedné skupiny do druhé (což je stejné jako procházení obdobím doprava), jádro přidává jak elektrony, tak protony ve stejné energetické úrovni..
Elektrony proto nemohou zabírat další vzdálenosti od jádra, což zvyšuje jeho kladný náboj, protože má více protonů. V důsledku toho elektrony zažívají větší přitažlivou sílu směrem k jádru a přitahují je čím dál tím více se zvyšujícím se počtem protonů..
Proto mají prvky na pravé straně periodické tabulky (žluté a tyrkysové sloupce) nejmenší atomové poloměry..
Na druhou stranu, když „skočíte“ z jedné periody do druhé (což je stejné jako říkat, že sestupujete dolů po skupině), nové povolené energetické úrovně umožňují elektronům zabírat vzdálenější prostory od jádra. Jelikož se nacházíme dále, jádro (s více protony) je přitahuje menší silou; a atomové poloměry se proto zvyšují.
Iontové poloměry
Iontové poloměry mají podobný vzorec jako atomové poloměry; Ty však nezávisí tolik na jádře, ale na tom, kolik nebo méně elektronů má atom vzhledem k neutrálnímu stavu.
Kationty (Na+, ACdva+, Do3+, Býtdva+, Víra3+) vykazují kladný náboj, protože ztratili jeden nebo více elektronů, a proto je jádro přitahuje větší silou, protože je mezi nimi méně odpuzování. Výsledek: kationty jsou menší než atomy, ze kterých jsou odvozeny.
A pro anionty (O.dva-, F-, Sdva-, Já-) naopak vykazují záporný náboj, protože mají přebytek jednoho nebo více elektronů, což zvyšuje jejich vzájemné odpuzování nad přitažlivostí vyvíjenou jádrem. Výsledek: anionty jsou větší než atomy, ze kterých jsou odvozeny (obrázek níže).
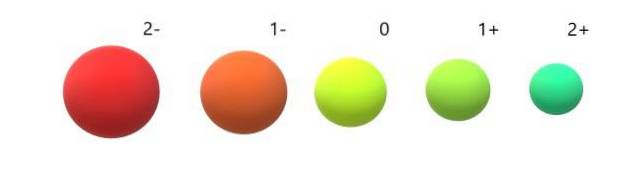
Oceňuje se, že 2- anion je nejobjemnější ze všech a kation 2+ nejmenší. Poloměry se zvyšují, když je atom záporně nabitý, a smršťují se, když je kladně nabitý..
-Elektronegativita
Když mají prvky malý atomový poloměr, jsou nejen jejich elektrony přitahovány velmi silně, ale také elektrony ze sousedních atomů, když vytvářejí chemickou vazbu. Tato tendence přitahovat elektrony z jiných atomů ve sloučenině je známá jako elektronegativita..
Jen proto, že je atom malý, neznamená, že bude elektronegativní. Pokud ano, prvky helium a vodík by byly nejvíce elektronegativními atomy. Hélium, jak věda ukázala, netvoří kovalentní vazbu jakéhokoli druhu; a vodík, má pouze jeden proton v jádře.
Když jsou atomové poloměry velké, jádra nemají dostatečnou sílu k přilákání elektronů z jiných atomů; proto jsou nejvíce elektronegativními prvky prvky s malým poloměrem atomu a větším počtem protonů.
Opět platí, že ti, kteří dokonale splňují tyto vlastnosti, jsou nekovové prvky p bloku periodické tabulky; Jedná se o ty, které patří do skupiny 16 nebo kyslíku (O, S, Se, Te, Po) a skupiny 17 nebo fluoru (F, Cl, Br, I, At).
Trend
Podle všeho, co bylo řečeno, jsou nejvíce elektronegativní prvky umístěny zejména v pravém horním rohu periodické tabulky; s fluorem jako prvkem v čele seznamu nejvíce elektronegativních.
Proč? Bez použití stupnic elektronegativity (Pauling, Mulliken atd.), I když je fluor větší než neon (ušlechtilý plyn své doby), může první vytvářet vazby, zatímco druhá nikoli. Kromě toho má jeho jádro pro svou malou velikost mnoho protonů a tam, kde je fluor, bude dipólový moment.
-Kovový charakter
Pokud má prvek ve srovnání s obdobím stejného období atomový poloměr a také není příliš elektronegativní, jedná se o kov a má vysoký kovový charakter.
Pokud se vrátíme k hlavnímu obrazu, načervenalé a nazelenalé koule, stejně jako šedé, odpovídají kovovým prvkům. Kovy mají jedinečné vlastnosti a odtud se periodické vlastnosti začínají prolínat s fyzickými a makroskopickými vlastnostmi hmoty..
Prvky s vysokým kovovým charakterem se vyznačují svými relativně velkými atomy, které se snadno ztrácejí elektrony, protože jádra je k nim těžko přitahují..
Ve výsledku jsou snadno oxidovány nebo ztraceny elektrony za vzniku kationtů, M.+; to neznamená, že všechny kationy jsou kovové.
Trend
V tomto okamžiku můžete předvídat, jak se mění kovový znak v periodické tabulce. Pokud je známo, že kovy mají velké kovové poloměry a že jsou také málo elektronegativní, mělo by se očekávat, že nejtěžší prvky (spodní období) jsou nejvíce kovové; a nejlehčí prvky (horní období), méně kovové.
Kovový charakter také klesá, čím více se prvek stane elektronegativním. To znamená, že procházením period a skupin napravo od periodické tabulky najdou ve svých horních obdobích méně kovové prvky..
Proto se kovový znak zvyšuje sestupně skupinou a ve stejném období klesá zleva doprava. Mezi kovovými prvky máme: Na (sodík), Li (lithium), Mg (hořčík), Ba (baryum), Ag (stříbro), Au (zlato), Po (polonium), Pb (olovo), Cd (kadmium) ), Al (hliník) atd.
-Ionizační energie
Pokud má atom velký poloměr atomu, lze očekávat, že jeho jádro neudrží elektrony v nejvzdálenějších skořápkách zachycených značnou silou. V důsledku toho jejich odstranění z atomu v plynné fázi (individualizované) nebude vyžadovat mnoho energie; tj. ionizační energie, EI, potřebovala k odstranění elektronu z nich.
EI je také ekvivalentní tvrzení, že je to energie, která musí být dodána k překonání přitažlivé síly jádra atomu nebo plynného iontu na jeho nejvzdálenější elektron. Čím menší je atom a čím elektronegativnější, tím nižší je jeho EI; to je váš trend.
Následující rovnice ilustruje příklad:
Na (g) => Na+(g) + e-
EI potřebná k dosažení tohoto cíle není ve srovnání s druhou ionizací tak velká:
Na+(g) => Nadva+(g) + e-
Protože v Na+ kladné náboje převládají a iont je menší než neutrální atom. V důsledku toho jádro Na+ přitahuje elektrony s mnohem větší silou, což vyžaduje mnohem větší EI.
-Elektronická afinita
A konečně je tu periodická vlastnost elektronické afinity. Toto je energetická tendence atomu prvku v plynné fázi přijímat elektron. Pokud je atom malý a má jádro s velkou přitažlivou silou, bude pro něj snadné přijmout elektron a vytvořit stabilní anion..
Čím stabilnější je anion vzhledem k neutrálnímu atomu, tím větší je jeho elektronová afinita. Do hry však vstupují také odpuzování mezi elektrony samotnými.
Například dusík má vyšší elektronovou afinitu než kyslík. Je to proto, že jeho tři 2p elektrony jsou nepárové a odpuzují se navzájem a přicházející elektron méně; zatímco v kyslíku existuje pár spárovaných elektronů, které vyvíjejí větší elektronický odpor; a ve fluoru existují dva páry.
Z tohoto důvodu se říká, že trend v elektronických afinitách se normalizuje od třetího období periodické tabulky..
Reference
- Shiver & Atkins. (2008). Anorganická chemie. (Čtvrté vydání). Mc Graw Hill.
- Whitten, Davis, Peck a Stanley. (2008). Chemie. (8. vydání). Učení CENGAGE.
- Prof. Ortega Graciela M. (1. dubna 2014). Periodické vlastnosti prvků. Barva abc. Obnoveno z: abc.com.py
- Chemistry LibreTexts. (7. června 2017). Periodické vlastnosti prvků. Obnoveno z: chem.libretexts.org
- Helmenstine, Anne Marie, Ph.D. (2. ledna 2019). Periodické vlastnosti prvků. Obnoveno z: thoughtco.com
- Toppr. (s.f.). Periodické vlastnosti prvků. Obnoveno z: toppr.com /
- Periodické vlastnosti prvků: Cesta přes stůl je cesta chemií. [PDF]. Obnoveno z: cod.edu


Zatím žádné komentáře