
Wrightova skvrna, materiály, technika a použití

The Wrightova skvrna je barvicí technika vytvořená americkým patologem Jamesem Homerem Wrightem v roce 1902, založená na Romanowského skvrně. Protože Romanowského skvrna byla nestabilní, Wright začlenil methanol jako rozpouštědlo a fixátor..
Toto zbarvení je polychromatické, což znamená, že generuje několik barev v závislosti na struktuře, která absorbuje barvivo. Tato technika barvení byla široce používána k provádění diferenciálního počtu bílých krvinek a ke studiu morfologie červených krvinek, krevních destiček a leukocytů v periferní krvi a kostní dřeni..
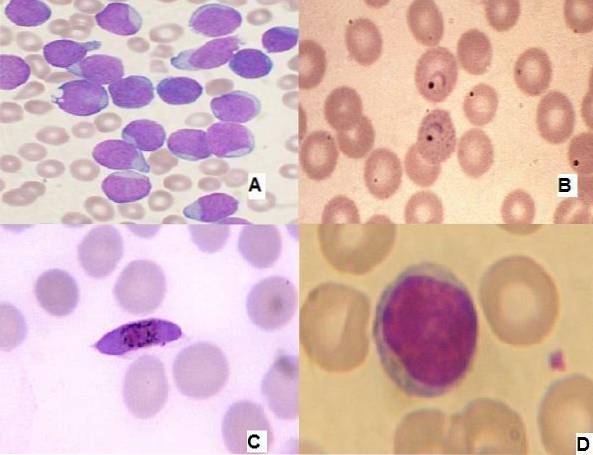
Jeho aplikace je velmi důležitá, protože lze pozorovat abnormality v různých buněčných liniích krve, což usnadňuje diagnostiku onemocnění, jako je leukémie nebo bakteriální nebo parazitární infekce..
Možná se jedná o nejběžnější aplikace, ve kterých se tato technika používá, nejsou však jediné. Je také užitečný ve vzorcích jiných než krev a kostní dřeň, jako je například výtok z nosu, fekální hlen, sputum, vzorky kůže, mimo jiné..
Rejstřík článků
- 1 Odůvodnění Wrightovy skvrny
- 2 Materiály
- 2.1 Příprava
- 2.2 Pufrovací roztok
- 2.3 Další materiály potřebné k provedení barvení
- 3 Složky Wrightovy skvrny
- 3.1 Metanol
- 3.2 Tlumič
- 3,3 eosin (Y)
- 3.4 Methylenová modř
- 4 Technika
- 5 Utility
- 5.1 Hematologie
- 5.2 Výtok z nosu
- 5.3 Parazitologie
- 5.4 Respirační infekce
- 5.5 Bakteriologie
- 5.6 Mykologie
- 6 Jak jsou struktury krevního vzorku pozorovány pomocí Wrightovy skvrny?
- 7 Doporučení pro dobré barvení
- 8 Běžné chyby ve Wrightově zbarvení
- 8.1 Velmi světlé zbarvení
- 8.2 Vysráží se barvivo
- 8.3 Šmouhy s extrémně načervenalým nebo modrým zbarvením
- 9 Režim úložiště
- 10 Reference
Odůvodnění Wrightovy skvrny
Barvivo Wright se zrodilo z barviva Romanowsky, které se skládá z methylalkoholového roztoku kyselého barviva (eosin Y) a zásaditého barviva (methylenová modř) a jejich oxidačních produktů..
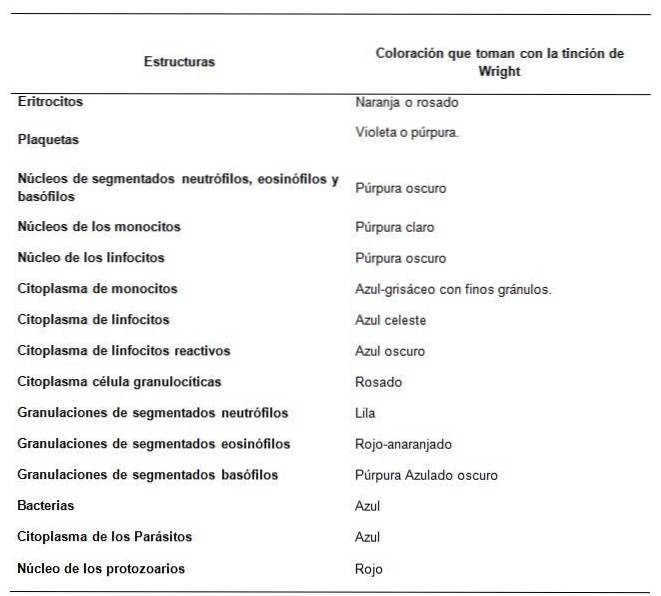
Směs barviv použitých ve Wrightově barvení způsobuje účinek známý jako Romanowsky, to znamená, že poskytuje nádherné fialové zbarvení jádrům leukocytů a neutrofilních granulí, zatímco červené krvinky se zbarvují do růžova..
Složky odpovědné za poskytnutí typického barevného gamutu Wrightova barvení jsou modrá B a eosin Y. Pozorovaný účinek bude záviset na vazbě barviv na chemické struktury a na interakcích modré B a eosinu Y.
Kyselé struktury, jako jsou nukleové kyseliny, jaderné proteiny a reaktivní nezralá cytoplazma některých buněčných typů, fixují modrou B (základní skvrna).
Zatímco základní struktury, jako je hemoglobin, granule segmentovaných eosinofilů, kromě jiných buněčných struktur, váží eosin Y (kyselé barvivo).
Výsledek barvení může být ovlivněn různými faktory, jako je pH barviva Wright, pufr a promývací roztok; stejně jako čas barvení a fixace.
Proto je každý krok přípravy činidel zásadní a musí být proveden s pečlivostí o každý detail..
Materiály
Wrightova skvrna. Pro 100 ml je vyžadováno:
Naváží se 0,3 g Wrightova barviva, odměří se 97 ml methanolu a 3 ml glycerolu.
Příprava
Do malty vložte velké množství Wrightova barviva a postupně přidávejte glycerol, dokud se prášek úplně nerozpustí..
Poté se přidá methanol, promíchá se a nalije do jantarové lahve.
Před použitím by měl být roztok jemnými pohyby protřepán a přefiltrován.
Pufrovaný pufrovací roztok
Do jednoho litru destilované vody se přidá 3,76 g hydrofosforečnanu sodného (NadvaHPO4 2Hdva0) plus 2,1 g dihydrogenfosforečnanu draselného (KHdvaPO4).
Velmi dobře promíchejte, dokud se nerozpustí všechna zabudovaná činidla. Upravte pH na 7,2. Nalijte do skleněné nádoby a udržujte při pokojové teplotě.
K provedení zbarvení jsou zapotřebí další materiály
Aby bylo možné provádět barvicí techniku, jsou navíc zapotřebí další materiály, a to jsou: sklíčka nebo krycí předměty, barvicí můstek, trička s vodou nebo pufrem na praní, stopky pro dodržení doby barvení a nějaký savý materiál. (savý papír, gáza nebo bavlna).
Složky Wrightovy skvrny
Methanolu
Alkohol (methanol) slouží jako fixátor krevního nátěru na podložní sklíčko.
Je to v zásadě redukční, dehydratační a koagulační fixační činidlo. Jeho funkcí je proto srážet proteiny a učinit je nerozpustnými, ale bez jejich skutečné denaturace..
Metanol je nejpoužívanějším činidlem pro fixaci stěrů ve všech laboratořích, protože poskytuje lepší výsledky než ethanol. Ideální koncentrace je 99%.
Tlumič
Pufr (pufrovaný roztok) má funkci úpravy nebo udržování pH barviva, protože pH upravené na 7,2 je nezbytné pro to, aby buněčné struktury mohly správně absorbovat barviva..
Na druhé straně krok fixace methanolu dehydratuje buňky a pufr jim pomáhá rehydratovat..
Eosin (Y)
Eosin má afinitu k stavebním kamenům, protože je to kyselé barvivo. Jsou známy dva typy eosinu, které jsou si navzájem velmi podobné, a to natolik, že lze použít kterýkoli z nich a získat stejný výsledek..
Jeden se nazývá eosin Y, žlutý eosin nebo tetrabromfluorescein a druhý se nazývá eosin B, modravý erytrosin B nebo dibromodinitrofluorescein. Nejčastěji se však používá eosin Y..
Nejdůležitější vlastností tohoto barviva je jeho negativní polarita, díky čemuž je přitahován ke kladně nabitým buněčným strukturám.
Methylenová modř
Je to základní zbarvení. Jeho hlavní vlastností je metachromasie, to znamená, že ne všechny struktury budou obarveny stejnou barvou, záleží na chemickém složení struktur, které jsou obarveny..
Některé budou světle nebo tmavě modré a jiné tmavě fialové nebo bledě fialové.
Technika
1 - Proveďte rozprostření vzorku tak, aby na podložce nebo krycím sklíčku zůstal tenký film.
2-Nechte uschnout na vzduchu přibližně 2 hodiny.
3 - Umístěte suchý nátěr na barvicí můstek nebo barvicí misku tak, aby vzorek směřoval nahoru..
4 Zakryjte list kapkou po kapce skvrnou Wright, dokud nebude pokryta celá plocha. Nechejte působit 5 - 8 minut.
5 - Skvrna by měla zcela zakrýt sklíčko, aniž by se rozlila přes okraje. Pokud se během doby barvení začne odpařovat, přidejte několik dalších kapek.
6-Následně přidejte stejné množství tlumiče, trochu pofoukejte, dokud se neobjeví charakteristický kovový lesk. Načasování 10 až 15 minut.
7-Umyjte vodou z vodovodu a jemným proudem umístěte, dokud list nebude vypadat růžově.
8 - Pomocí gázy napuštěné alkoholem odstraňte barvivo nalepené na zadní straně sklíčka.
9 - Před nanesením imerzního oleje jej nechejte velmi dobře zaschnout, abyste jej mohli prohlédnout pod mikroskopem.
Užitečnost
Hematologie
Je ideální pro barvení nátěrů periferní krve, pro vyšetření silných krevních nátěrů a pro studium buněk ze vzorků kostní dřeně.
Díky chemickým vlastnostem této kombinace barviv lze snadno rozpoznat buněčné struktury, které dokážou rozlišit různé typy přítomných buněk.
Rýma
Tato technika je velmi užitečná pro identifikaci buněk nosního výtoku (epiteliální buňky, segmentované eosinofily, polymorfonukleární buňky) při diagnostice alergické rýmy..
parazitologie
V tomto smyslu to bylo užitečné pro studium Leishmania sp v histiocytech podkožní buněčné tkáně v kožních vředech. Podobně se používá k identifikaci leukocytů ve vzorcích stolice (fekální leukogram).
V tomto případě je pro lékaře zajímavé vědět, zda je leukocytóza přítomná ve stolici polymorfonukleární nebo mononukleární. Toto zjištění ve fekálním leukogramu bude vodítkem, zda se jedná o bakteriální nebo virovou infekci..
Na druhou stranu paraziti cirkulující v krvi se nacházejí v erytrocytech nebo jsou volní v plazmě. Hledaní paraziti jsou Plasmodium spp, Trypanosoma cruzii a filariae a ve veterinární medicíně je to užitečné při hledání Theileria equi Y Babesia caballi, původci bebesiózy, zejména u koňovitých.
Wrightovo barvení a také Giemsovo barvení umožňuje odlišit hemoparazity od normálních buněčných složek. K tomu lze použít dva typy spready:
Roztírá se dobře
Krev se šíří jako tenký film na podložním sklíčku. Obarvený Wrightovou skvrnou, odhalující vlastnosti jádra a cytoplazmy.
Silný pokles
Tato metodika se používá k vyšetřování přítomnosti parazitů ve větším množství krve..
K tomu je na sklíčko umístěna velká kapka krve. Jakmile tam bude, musí být defibrilován, a to tak, aby se okraje dalšího sklíčka vytvářely stále větší a větší kruhy od středu směrem ven..
Nakonec, aby bylo možné pozorovat parazity v hustém nátěru, musí být erytrocyty lyžovány vodou..
Respirační infekce
Na úrovni dýchání je tato technika také užitečná, protože pro stanovení diagnózy jsou důležité buňky přítomné ve vzorcích sputa, výplachu průdušek nebo bronchoalveolárních..
Podobně zde lze rozlišit polymorfonukleární buňky a mononukleární buňky..
Bakteriologie
Použití této techniky v bakteriologii je omezené, protože není dobré pro barvení bakterií, a proto se k jejich barvení používají jiné specializované techniky barvení..
Používá se však k hledání epiteliálních buněk s inkluzními tělísky Chlamydia trachomatis v nátěrech uretrální nebo endocervikální sliznice, i když je třeba si uvědomit, že to není nejlepší metoda.
Je také možné pozorovat spirálovité bakterie, jako jsou Borrelia burgdorferi u infikovaných pacientů, jakož i morulae nebo inkluzních tělísek Ehrlichia sp v cytoplazmě lymfocytů, monocytů nebo neutrofilů v krevním nátěru.
Mykologie
The Histoplasma capsulatum je patogenní houba často diagnostikovaná mikroskopickým pozorováním různých vzorků tkání obarvených Wrightovým barvivem.
Jak jsou struktury vzorku krve pozorovány pomocí Wrightovy skvrny?
Doporučení pro dobré barvení
Nátěry vzorků krve by měly spontánně uschnout na vzduchu. Nátěry by měly být co nejtenčí, aby se dosáhlo lepší fixace barviva a zabránilo se zabarvení..
U vysoce kvalitního barvení je vhodné barvit do dvou hodin od přípravy nátěru. Na druhou stranu je ideálním vzorkem kapilární krev bez antikoagulancia.
Pokud se však použije žilní krev, měla by se použít jako antikoagulant EDTA a ne jako heparin, protože ten může deformovat buněčné struktury.
Aby nedošlo k poškození připraveného barviva, mělo by být skladováno na suchých místech.
Během procesu praní se doporučuje používat vodu upravenou na neutrální pH..
Nakonec je vhodné testovat metody barvení používané v laboratoři tak často..
To se provádí barvením vzorků nebo rozšířených vzorů jako kontroly kvality. Tento krok je důležitý, protože zajišťuje, že barvení je řádně připraveno a doby barvení jsou dobře standardizovány..
Pokud je vzorový list špatně zbarvený, pak je třeba vyřešit problémy..
Časté chyby ve Wrightově barvení
Velmi bledé skvrny
Velmi bledé šmouhy jsou obvykle způsobeny velmi krátkou dobou zbarvení nebo nadměrným praním. Koriguje se prodloužením doby kontaktu s barvivem nebo snížením doby praní.
Vysráží se barvivo
Přítomnost sraženin barviva v nátěru může mít několik příčin, nejčastějšími příčinami však jsou: použití nefiltrovaného barviva, barvení na nerovnoměrných barvicích můstcích, použití listů znečištěných prachem nebo mastnotou, špatné mytí.
Extrémně červená nebo modrá skvrna
Pufr je zodpovědný za pH barviva. Barviva s nižším pH, než je uvedeno (kyselé), způsobí velmi načervenalé skvrny..
Pokud je pH barviva vyšší (alkalické), získá se extrémně namodralý nátěr.
Režim úložiště
Činidlo by mělo být skladováno při pokojové teplotě.
Reference
- Gutiérrez V. Srovnávací studie mezi metodou Wrightova barvení a testem Elisa pro diagnostiku psí Ehrlichiózy ve městě San Pedro Sula v Hondurasu. 2008. Diplomová práce pro získání titulu Veterinární lékař. University of San Carlos of Guatemala.
- López-Jácome L, Hernández-Durán M, Colín-Castro C, Ortega-Peña S, Cerón-González G, Franco-Cendejas F. Základní skvrny v mikrobiologické laboratoři. Výzkum v oblasti zdravotního postižení. 2014; 3 (1): 10-18.
- „Wrightova skvrna.“ Wikipedia, The Free Encyclopedia. 18. května 2018, 12:05 UTC. 8. prosince 2018, 20:37
- Calderón A, Cardona J, Vergara Ó. Četnost Babesia spp. na koních montería, Córdoba (Kolumbie). Rev. udcaactual divulg cient. 2013; 16 (2): 451-458.
- Forbes B, Sahm D, Weissfeld A (2009). Bailey & Scott mikrobiologická diagnostika. 12 ed. Argentina. Redakční Panamericana S.A.
- Retamales E, Mazo V. Institute of Public Health Government of Chile. Doporučení pro barvení krevních nátěrů pro čtení krevního obrazu.



Zatím žádné komentáře