
Struktura, vlastnosti, použití acetonitrilu (C2H3N)
The acetonitril Je to látka organického původu složená pouze z uhlíku, vodíku a dusíku. Tento chemický druh patří do skupiny nitrilů, přičemž acetonitril je ten s nejjednodušší strukturou mezi těmi organickými..
Nitrily jsou třídou chemických sloučenin, jejichž strukturu tvoří kyanidová skupina (CN-) a radikální řetězec (-R). Tyto prvky jsou reprezentovány následujícím obecným vzorcem: R-C≡N.
Je známo, že tato látka pochází primárně při výrobě jiného druhu zvaného akrylonitril (další jednoduchý nitril, molekulárního vzorce C3H3N, který se používá při výrobě výrobků v textilním průmyslu) jako jeho vedlejší produkt.
Kromě toho je acetonitril považován za rozpouštědlo se středními polaritami, a proto se poměrně často používá při analýzách RP-HPLC (reverzní fáze, vysoce účinná kapalinová chromatografie)..
Rejstřík článků
- 1 Struktura
- 2 Vlastnosti
- 3 použití
- 4 Rizika
- 5 Reference
Struktura
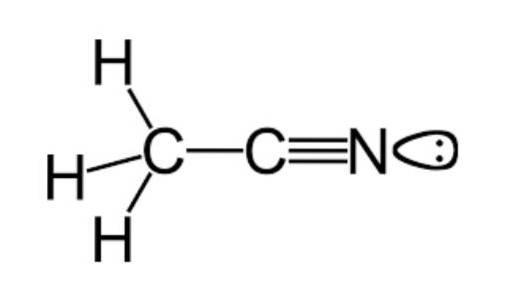
Jak již bylo zmíněno dříve, acetonitril patří do funkční skupiny nitrilů, které mají molekulární vzorec běžně představovaný jako CdvaH3N, což lze vidět ve strukturním vzorci, který je ilustrován na horním obrázku.
Tento obrázek ukazuje druh laloku připojeného k atomu dusíku, který představuje dvojici nepárových elektronů, které tento atom má, a které mu dodávají velkou část vlastností reaktivity a stability, které jsou pro něj charakteristické..
Tímto způsobem tento druh vykazuje velmi zvláštní chování díky svému strukturálnímu uspořádání, které se promítá do slabosti pro příjem vodíkových vazeb a malé schopnosti darovat elektrony..
Tato látka také poprvé vznikla ve druhé polovině 40. let 20. století a vyrábí ji vědec Jean-Baptiste Dumas, jehož státní příslušnost byla francouzská..
Strukturální konformace této látky jí umožňuje mít vlastnosti vlastního rozpouštědla organické povahy..
Tato vlastnost zase umožňuje, aby byl acetonitril smíchán s vodou, stejně jako s řadou dalších rozpouštědel organického původu, s výjimkou uhlovodíků nebo uhlovodíků nasyceného typu..
Vlastnosti
Tato sloučenina má řadu vlastností, které ji odlišují od ostatních stejné třídy, které jsou uvedeny níže:
- Je v kapalném stavu agregace za standardních podmínek tlaku a teploty (1 atm a 25 ° C).
- Jeho molekulární konfigurace mu dává molární hmotnost nebo molekulovou hmotnost přibližně 41 g / mol.
- Považuje se za nitril, který má nejjednodušší strukturu mezi organickými typy.
- Jeho optické vlastnosti umožňují, aby byl v této kapalné fázi bezbarvý a s průzračnými vlastnostmi, kromě toho, že má aromatický zápach..
- Má bod vzplanutí kolem 2 ° C, což odpovídá 275,1 K..
- Má bod varu v rozmezí 81,3 až 82,1 ° C, hustotu přibližně 0,786 g / cm3 a bod tání, který je mezi -46 až -44 ° C.
- Je méně hustý než voda, ale je mísitelný s ním as různými organickými rozpouštědly.
- Vykazuje dielektrickou konstantu 38,8 navíc k dipólovému momentu přibližně 3,92 D..
- Je schopen rozpouštět širokou škálu látek iontového původu a nepolární povahy.
- Je široce používán jako mobilní fáze v HPLC analýze, která má vysoké hořlavosti.
Aplikace
Mezi velký počet aplikací, které má acetonitril, lze počítat následující:
- Podobně i jiné druhy nitrilů mohou podstoupit proces metabolizace v mikrosomech (vezikulární prvky, které jsou součástí jater), zejména v tomto orgánu, za vzniku kyseliny kyanovodíkové..
- Je široce používán jako mobilní fáze v typu analýzy nazývané vysoce účinná kapalinová chromatografie s reverzní fází (RP-HPLC); tj. jako eluční látka, která má vysokou stabilitu, velkou eluční sílu a nízkou viskozitu.
- V případě aplikací průmyslové velikosti se tato chemická sloučenina používá v rafinériích ropy jako rozpouštědlo v určitých procesech, jako je čištění alkenu zvaného butadien..
- Používá se také jako ligand (chemická látka, která se spojuje s atomem kovového prvku, který je považován za centrální v dané molekule, za vzniku sloučeniny nebo koordinačního komplexu) ve velkém počtu nitrilových sloučenin s kovy přechodové skupiny.
- Podobně se používá v organické syntéze pro velké množství takových výhodných chemikálií, jako je kyselina a-naftalen-octová, thiamin nebo hydrochlorid acetamidinu..
Rizika
Rizika spojená s expozicí acetonitrilu jsou různá. Mezi ně patří snížená toxicita, když je expozice po kratší dobu a v malém množství a je metabolizována za vzniku kyseliny kyanovodíkové..
Podobně vzácně byly zaznamenány případy lidí, kteří byli otráveni těmito chemickými látkami a byli otráveni kyanidem přítomným v molekule po kontaktu s acetonitrilem v různých stupních (při vdechování, požití nebo absorpci kůží).
Z tohoto důvodu jsou důsledky jeho toxicity zpožděny, protože tělo tuto látku snadno nemetabolizuje na kyanid, protože to trvá dvě až dvanáct hodin..
Acetonitril se však snadno vstřebává z plic a gastrointestinálního traktu. Následně k jeho distribuci dochází v celém těle, děje se u lidí a dokonce iu zvířat a zasahuje ledviny a slezinu..
Na druhé straně, kromě rizik hořlavosti, která představuje, je acetonitril prekurzorem toxických látek, jako je kyselina kyanovodíková nebo formaldehyd. Jeho použití ve výrobcích kosmetické oblasti bylo v roce 2000 dokonce zakázáno v takzvaném Evropském hospodářském prostoru..
Reference
- Wikipedia. (s.f.). Acetonitril. Citováno z en.wikipedia.org
- PubChem. (s.f.). Acetonitril. Obnoveno z pubchem.ncbi.nlm.nih.gov
- Brown, P. R. (2000). Pokroky v chromatografii. Získané z books.google.co.ve
- ScienceDirect. (s.f.). Acetonitril. Citováno z sciencedirect.com
- ChemSpider. (s.f.). Acetonitril. Obnoveno z chemspider.com



Zatím žádné komentáře