
Struktura adiponektinu, funkce, receptory, mechanismus účinku
The adiponektin je to jeden z nejhojnějších sekrečních proteinů produkovaných speciálním typem buněk známých jako adipocyty, charakteristickým pro tukovou tkáň. Je odpovědný za zvýšení citlivosti na inzulín a podílí se na energetické homeostáze a obezitě.
Gen lidského adiponektinu byl klonován z tukové tkáně v roce 1996, během pokusů Matsuzawy, který jej označil za nejhojnější transkript genu pro tukový tuk (apM1). tukový nejhojnější genový transkript 1).
Na druhé straně byl protein identifikován v krevní plazmě téhož roku Nakano et al..
Tento hormon přispívá k integraci endokrinních a metabolických signálů, které souvisejí s kontrolou energetické homeostázy. Jeho exprese je indukována během diferenciace adipocytů a cirkuluje v séru v relativně vysokých koncentracích..
Rejstřík článků
- 1 Struktura
- 2 Funkce
- 3 přijímače
- 3.1 T-kadherin
- 4 Mechanismus působení
- 5 Normální hodnoty
- 6 Reference
Struktura
Adiponektin patří do rodiny komplementu 1q (C1q) a lze jej nalézt v krevní plazmě v široké škále multimerních komplexů (několika podjednotek): trimery, hexamery a multimery s vysokou molekulovou hmotností (více než 18 podjednotek).
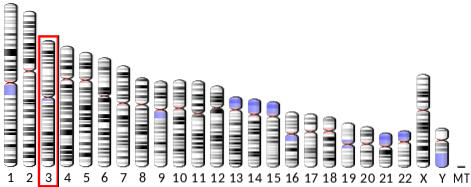
Gen, který kóduje adiponektin (ADIPOQ) se nachází na dlouhém rameni chromozomu 3 u lidí, má 16 kilobází a 3 exony. Jeho exprese poskytuje ve vodě rozpustný protein složený z 247 aminokyselinových zbytků a molekulové hmotnosti těsně pod 30 kDa, s izoelektrickým bodem 5,42.
Skládá se ze čtyř domén: signální sekvence na N-terminálním konci, variabilní oblast, kolagenová doména (cAd) a globulární C-terminální doména..
V aminoterminální části se rozlišuje kolagenová sekvence známá jako kolagenová doména, což je oblast velmi důležitá pro tvorbu multimerů a je vysoce konzervativní mezi druhy.
Hydroxylace a současná glykosylace lysinových zbytků v kolagenové doméně tohoto proteinu je to, co umožňuje tvorbu trimerů, které se mohou současně spojovat za vzniku hexamerů a dalších komplexů s vysokou molekulovou hmotností..
Tyto komplexy mají zjevně „cílovou“ specificitu pro tkáně, například komplexy s vysokou molekulovou hmotností jsou aktivnější v játrech, zatímco trimery a hexamery působí bez velkého rozdílu v široké škále tkání..
Globulární oblast na C-konci, nazývaná globulární doména nebo gAd, je homologní k proteinům, jako je kolagen VIII a kolagen X, stejně jako faktor komplementu C1q..
Funkce
Obecně se má za to, že hormon adiponektin působí relevantním způsobem při regulaci metabolismu lipidů a sacharidů v různých tkáních citlivých na inzulín..
Působí na různé tělesné tkáně, protože jeho receptory jsou exprimovány na několika místech. Adiponektin, produkovaný výhradně adipocyty, podporuje biosyntézu mastných kyselin a inhibici glukoneogeneze v játrech, jedné z tkání, kde se nachází jeho receptor AdipoR2..
V kosterním svalu, kde se nacházejí receptory AdipoR1 a AdipoR2, podporuje oxidaci mastných kyselin a vstup glukózy do svalových buněk.
Adiponektin také zlepšuje rezistenci na inzulín u některých pacientů, protože snižuje množství intracelulárního tuku aktivací oxidace mastných kyselin jak ve svalu, tak v játrech..
Někteří autoři naznačují, že tento hormon působí také jako antioxidant, jako protizánětlivý prostředek a jako anti-arteriosklerotický faktor.
Přijímače
Zdá se, že různé komplexy adiponektinu mají určitou přednost před specifickými tkáněmi. Tyto tkáňově specifické interakce se vyskytují v reakci na rozdílnou expresi různých typů receptorů adiponektinu..
Adiponektinové receptory (AdipoR) jsou receptory spojené s G-proteinem patřící do rodiny receptorů známých jako PAQR. Jsou známy dva typy: AdipoR1 a AdipoR2. Oba udržují své N-koncové domény v intracelulárním prostoru, zatímco jejich C-koncové domény jsou vystaveny směrem do extracelulárního prostoru..
Receptory typu AdipoR1 mají 375 aminokyselin a molekulovou hmotnost 42 kDa, zatímco receptory typu AdipoR2 mají 311 aminokyselin a hmotnost 35 kDa. Oba mají 7 transmembránových domén, to znamená, že jejich struktura prochází plazmatickou membránou buněk, kde se nacházejí 7krát..
Mezi oběma receptory existuje přibližně 70% sekvenční homologie, s výjimkou jejich N-koncových konců, které jsou specifické pro každý z nich..
Jak AdipoR1, tak AdipoR2 jsou exprimovány ve všech tkáních, i když jejich počet se liší od jedné k druhé. AdipoR1 je primárně v kosterním svalu a AdipoR2 je jak v kosterním svalu, tak v játrech.
T-kadherin
Existuje také „domnělý“ receptor pro adiponektin známý jako T-kadherin, který se skládá z jediné molekuly kadherinu, která ztratila své cytosolické a transmembránové domény a je navázána na povrch buňky prostřednictvím kotev glykosylfosfatidylinositolu (kotvy GPI).
Tento „receptor“ adiponektinu je exprimován ve všech tkáních, ale byl zaznamenán s vyšším výskytem v srdci, v aortálních, karotických a iliakálních tepnách a v renálních tepnách..
Mechanismus účinku
I když mechanismy produkce a uvolňování adiponektinu do krevního řečiště nejsou plně pochopeny, předpokládá se, že signální transdukční cesta začíná vazbou adiponektinu na membránové receptory na jeho cílových buňkách..
Tento hormon indukuje aktivaci AMP-aktivované proteinkinázy (AMPK), ke které dochází prostřednictvím „adaptačního“ proteinu, který obsahuje doménu homologie s pleckstrinem (typická pro proteiny zapojené do procesů buněčné signalizace) a doménu vazby fosfotyrosinu (PTB). , plus motiv uzavření leucinem 1 (APPL).
APPL doména je doména, která se váže na intracelulární část jednoho ze dvou receptorů AdipoR. Malý protein GTPázy známý jako Rab5 se váže na jedno z míst leucinové uzavírací domény a podporuje membránovou translokaci GLUT4, inzulínem regulovaného transportéru glukózy..
Kromě toho působí adiponektin na nukleární transkripční faktor známý jako PPARα, což je důležité z hlediska metabolismu bílkovin, lipidů a sacharidů, stejně jako buněčné diferenciace a vývoje..
Normální hodnoty
Normální hodnoty uváděné pro adiponektin v krevní plazmě odpovídají multimerním komplexům tohoto proteinu, jejichž koncentrační rozmezí je mezi 5 a 20 mikrogramy na mililitr, ačkoli byly dokumentovány také koncentrace až 30 mikrogramů na mililiter..
Vzhledem k výše uvedenému stojí za zmínku, že koncentrace adiponektinu v plazmě se významně liší; například ženy mají tendenci mít vyšší hodnoty než muži.
Hodnoty tohoto hormonu do značné míry závisí na stavu výživy, přítomnosti nebo nepřítomnosti jakékoli patologie atd., Obecně však nepřímo korelují s adipozitou a se stavy, jako jsou kardiovaskulární onemocnění, hypertenze a metabolické syndromy..
Existují zprávy, které zajišťují snížení plazmatických koncentrací adiponektinu u pacientů, kteří trpí patologickými stavy, jako je inzulínová rezistence a obezita.
Reference
- Chandran, M., Phillips, S.A., Ciaraldi, T., & Henry, R. R. (2003). Adiponektin: více než jen další hormon tukových buněk? Diabetes care, 26 (8), 2442-2450.
- Hirako, S. (2016). Adiponektin. V příručce hormonů (str. 308-e34B). Akademický tisk.
- Kadowaki, T. a Yamauchi, T. (2005). Adiponektin a receptory adiponektinu. Endocrine reviews, 26 (3), 439-451.
- Kadowaki, T., Yamauchi, T., Kubota, N., Hara, K., Ueki, K., & Tobe, K. (2006). Adiponektin a receptory adiponektinu v inzulínové rezistenci, cukrovce a metabolickém syndromu. The Journal of Clinical research, 116 (7), 1784-1792.
- Klein, S., & Romijn, J. A. (2007). Kapitola 35 - Obezita. Williamsova učebnice endokrinologie, 11, 1568-1569.
- Steyn, F. J. a Chen, C. (2013). Adiponektin.



Zatím žádné komentáře