
Pozadí, příprava a použití LIA agaru (lysinové železo)
The LIA agar (Iron Lysine) je biochemický test používaný k identifikaci bakterií z čeledi Enterobacteriaceae. Toto médium vytvořili Edwards a Fife na základě vzorce Falkow.
Původně tento test byl bujón obsahující peptony, kvasnicový extrakt, glukózu, L-lysin, bromkrezolovou fialovou a destilovanou vodu. Edwards a Fife přidali agar-agar, citrát železito-amonný a thiosíran sodný..
Test v podstatě spočívá v prokázání přítomnosti enzymu lysin dekarboxylázy, schopného reagovat s karboxylovou skupinou aminokyseliny L-lysinu. Deaminace aminokyseliny může také nastat v důsledku přítomnosti enzymu lysindeaminázy..
Složení média navíc umožňuje důkaz schopnosti některých bakteriálních rodů produkovat sirovodík. Nakonec je také možné pozorovat tvorbu plynu v médiu či nikoli.
Rejstřík článků
- 1 Odůvodnění
- 1.1 Peptony a kvasnicový extrakt
- 1,2 Glukóza
- 1,3 L-lysin
- 1.4 Indikátor pH (bromkrezolová fialová)
- 1.5 Citronan amonný a thiosíran sodný
- 2 Interpretace testu
- 2.1 Dekarboxylace lysinu
- 2.2 Deaminace lysinu
- 2.3 Výroba sirovodíku (H2S)
- 3 Záznam výsledků
- 4 Příprava
- 5 použití
- 6 Reference
Základ
Peptony a kvasnicový extrakt
Jako většina kultivačních médií obsahuje lysinový železný agar složky, které poskytují zdroj živin nezbytných pro růst bakterií. Tyto složky představují peptony a kvasnicový extrakt.
Glukóza
Podobně tento agar obsahuje glukózu jako fermentovatelný sacharid. Je známo, že všechny bakterie z čeledi Enterobacteriaceae fermentují glukózu.
Tento krok je zásadní, protože bude zodpovědný za okyselení média, což je základní podmínka pro působení enzymu lysin dekarboxylázy, pokud je přítomen, aby působil na jeho substrát..
V některých bakteriálních rodech lze pozorovat produkci plynu v důsledku fermentace glukózy.
Plyn je patrný, když dojde k posunutí agaru v trubici a ponechání prázdného prostoru na dně trubice nebo zlomením média na dvě nebo více částí.
L-lysin
Jakmile je lysin dekarboxylován, vznikne diamin (kadaverin) a oxid uhličitý.
K dekarboxylaci dochází v přítomnosti pyridoxal fosfátového koenzymu. Tato reakce je nevratná.
Indikátor PH (bromokrezolová fialová)
Všechny změny pH, ke kterým dochází v médiu v důsledku různých reakcí, jsou detekovány fialovým indikátorem pH bromokrezolu..
V tomto smyslu při okyselení médium zezelená a při alkalizaci se médium vrátí do své původní fialové nebo fialové barvy..
Když dojde k deaminaci lysinu v důsledku přítomnosti enzymu lysindeaminázy, vytvoří se na povrchu načervenalé zabarvení, typické pro rody Proteus, Providencia a některé druhy Morganella.
To je způsobeno skutečností, že během procesu deaminace vzniká kyselina alfa-keto-uhličitá, která reaguje s citronanem amonným v přítomnosti kyslíku a způsobuje výše uvedené zabarvení..
Citronan amonný a thiosíran sodný
Na druhé straně o bakteriích, které produkují sirovodík, bude svědčit přítomnost thiosíranu sodného (zdroj síry) a citrátu železitého amonného, který je vývojářem HdvaS.
Bakterie, které mají enzym thiosíran reduktázu, mají schopnost působit snížením přítomného thiosíranu sodného za vzniku siřičitanu a sirovodíku (HdvaS).
Ten druhý je bezbarvý plyn, ale když reaguje se solí železa, vytváří sulfid železnatý, který je nerozpustnou sloučeninou (viditelná černá sraženina).
Nicméně, formační kapacita HdvaS s tímto médiem není příliš spolehlivý, protože některé lysin dekarboxylázy negativní bakterie schopné produkovat HdvaS nevytvoří černou sraženinu, protože narušuje kyselost média. Proto se doporučuje zkontrolovat s jinými médii obsahujícími železo.
Interpretace testu
Lysinová dekarboxylace
Zkumavky by měly být odečteny po 24 hodinách inkubace, jinak existuje riziko nesprávné interpretace reakce a hlášení falešných negativ.
Je třeba si uvědomit, že první reakcí, která nastane, bude fermentace glukózy, proto všechny zkumavky po 10 až 12 hodinách zožltnou..
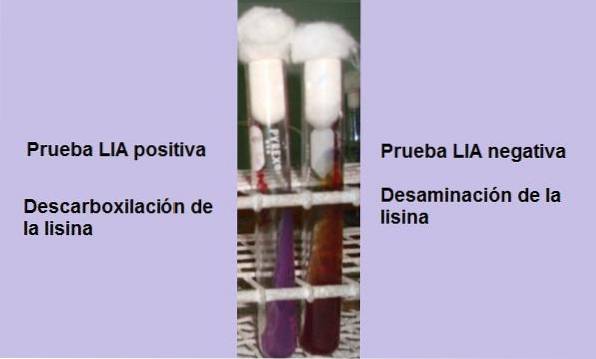
Pokud je na konci inkubační doby (24 hodin) pozorováno žluté pozadí s fialovým nebo fialovým povrchem, reakce je negativní. Fialová barva povrchu odpovídá alkalizaci média použitím peptonů.
Pozitivní reakce je reakce, při které jsou dno a povrch tuby úplně fialové, to znamená, že se vrátí do původní barvy..
Kdo tedy určuje pozitivitu testu, je základna nebo pozadí média. Pokud máte pochybnosti o barvě, lze ji přirovnat k neočkované zkumavce LIA.
Deaminace lysinu
Zkumavka, která vykazuje deaminaci lysinu, bude mít načervenalý kaštanový povrch a žluté (kyselé) pozadí, nebo celá zkumavka bude mít červenohnědou barvu..
Tato reakce je interpretována jako negativní pro dekarboxylaci lysinu, ale pozitivní pro deaminaci lysinu..
Tato reakce je definována a interpretována na lunetě.
Výroba sirovodíku (H.dvaS)
Pozitivní reakce je pozorována výskytem černé sraženiny v celém nebo části média. Obvykle mezi hranou úkosu a základnou.
Pokud se sraženina vyskytne v celé zkumavce, neukáže další reakce, ke kterým dojde ve středu..
Záznam výsledků
Při interpretaci testu se výsledky zaznamenávají takto:
Nejprve se načte rámeček, poté spodní část nebo blok, poté se vyrobí HdvaAno, a nakonec výroba plynu.
Příklad: K / A + (-). To znamená:
- K: Alkalický rámeček (fialová barva)
- A: Kyselé pozadí (žluté), tj. Negativní dekarboxylační reakce a negativní deaminace.
- +: Výroba sirovodíku
- (-): Bez plynu.
Příprava
Naváží se 35 g dehydratovaného lysinového média na agaru železa a rozpustí se v jednom litru destilované vody..
Zahřívejte, dokud se agar úplně nerozpustí. Za tímto účelem nechejte za stálého míchání minutu povařit. Rozdělte 4 ml média do 13/100 zkumavek s bavlněnými čepičkami.
Sterilizujte v autoklávu při teplotě 121 ° C po dobu 15 minut. Vyjměte z autoklávu a nechejte stát pod úhlem, aby byla hluboká základna a krátký úkos.
Uchovávejte v chladničce 2-8 ° C. Před zasetím bakteriálního kmene nechte ohřát.
Dehydratované médium je béžové a připravené médium je červenofialové..
Konečné pH připraveného média je 6,7 ± 0,2
Médium zžloutne s pH rovným nebo menším než 5,2 a při pH 6,5 a vyšším je fialové.
Aplikace
Tento test se spolu s dalšími biochemickými testy používá k identifikaci bacilů z čeledi Enterobacteriaceae..
Médium je naočkováno přímou smyčkou nebo jehlou, jeden nebo dva vpichy jsou provedeny na dně zkumavky a poté je povrch média rýhován klikatě..
Inkubujte po dobu 24 hodin při 35-37 ° C v aerobióze. V případě potřeby inkubujte dalších 24 hodin..
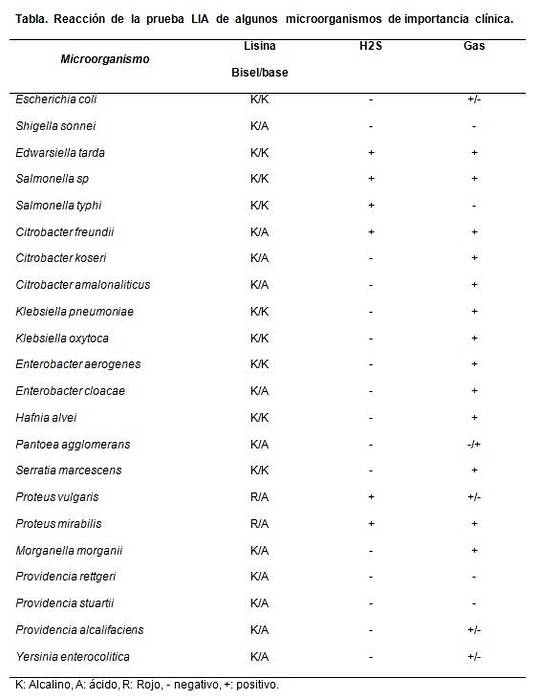
Je hlavně užitečné odlišit od druhu Citrobacter negativní na laktózu Salmonellas sp.
Reference
- Mac Faddin J. (2003). Biochemické testy pro identifikaci bakterií klinického významu. 3. vyd. Redakční Panamericana. Buenos Aires. Argentina.
- Forbes B, Sahm D, Weissfeld A. (2009). Bailey & Scott mikrobiologická diagnostika. 12 ed. Redakční Panamericana S.A. Argentina.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Mikrobiologická diagnostika. 5. vyd. Redakční Panamericana S.A. Argentina.
- Britannia Laboratories. Lysinový železný agar. 2015. Dostupné na: britanialab.com
- BD Laboratories. BBL lysinové železo agarové sklony. 2007. Dostupné na: bd.com
- Valtek Laboratories. Middle L.I.A. 2009. Dostupné na: andinamedica.com



Zatím žádné komentáře