
Struktura aminu, vlastnosti, typy, použití, příklady
The aminy jsou to organické sloučeniny odvozené od amoniaku. V nich jsou kovalentní vazby mezi uhlíkem a dusíkem. Přirozeně je molekula dusíku kineticky inertní; ale díky biologické fixaci se transformuje na amoniak, který zase podléhá následným alkylačním reakcím.
Když je amoniak „alkylován“, nahradí jeden, dva nebo tři ze svých tří vodíků atomy uhlíku. Tyto uhlíky mohou dobře pocházet z alkyl (R) nebo aryl (Ar) skupiny. Existují tedy alifatické aminy (lineární nebo rozvětvené) a aromatické.

Obecný vzorec pro alifatické aminy je uveden výše. Tento vzorec lze použít pro aromatické aminy, vzhledem k tomu, že R může být také arylová skupina Ar. Všimněte si podobnosti mezi aminem a amoniakem, NH3. Prakticky byl H nahrazen postranním řetězcem R..
Pokud R sestává z alifatických řetězců, máte něco, co je známé jako alkylamin; zatímco pokud R má aromatickou povahu, arylamin. Z arylaminů je nejdůležitější ze všech alanin: aminoskupina, -NHdva, vázaný na benzenový kruh.
Pokud jsou v molekulární struktuře okysličené skupiny, jako jsou OH a COOH, sloučenina se již neoznačuje jako amin. V takovém případě je amin považován za substituent: aminoskupinu. Například k tomu dochází v aminokyselinách, stejně jako v jiných biomolekulách, které mají pro život nesmírný význam..
Protože dusík se nachází v mnoha esenciálních sloučeninách pro život, byly považovány za životně důležité aminy; tj. „vitamíny“. Mnoho vitamínů však není ani amin, a navíc ne všechny jsou životně důležité. To však nevyvrací jeho velký význam pro živé organismy..
Aminy jsou silnější organické zásady než samotný amoniak. Jsou snadno extrahovatelné z rostlinné hmoty a obecně mají silné interakce s neuronovou matricí organismů; proto mnoho léčiv a léčiv sestávají z aminů se složitými strukturami a substituenty.
Rejstřík článků
- 1 Struktura
- 2 Vlastnosti aminů
- 2.1 Polarita
- 2.2 Fyzikální vlastnosti
- 2.3 Rozpustnost ve vodě
- 2.4 Zásadnost
- 3 typy (primární, sekundární, terciární)
- 4 Školení
- 4.1 Alkylace amoniaku
- 4.2 Katalytická hydrogenace
- 5 Názvosloví
- 6 použití
- 6.1 Barviva
- 6.2 Drogy a drogy
- 6.3 Úprava plynu
- 6.4 Zemědělská chemie
- 6.5 Výroba pryskyřic
- 6.6 Živočišné živiny
- 6.7 Gumárenský průmysl
- 6.8 Rozpouštědla
- 7 příkladů
- 7.1 Kokain
- 7.2 Nikotin
- 7.3 Morfin
- 7.4 Serotonin
- 8 Reference
Struktura
Jaká je jeho struktura? I když se liší v závislosti na povaze R, elektronické prostředí atomu dusíku je pro všechny stejné: čtyřboká. Ale protože na atomu dusíku (·) je pár nesdílených elektronů, stane se molekulární geometrie pyramidální. To je případ amoniaku a aminů.
Aminy mohou být reprezentovány čtyřstěnem, stejně jako sloučeniny uhlíku. NH3 a CH4 jsou nakresleny jako čtyřstěny, kde dvojice (··) je umístěna na jednom z vrcholů nad dusíkem.
Obě molekuly jsou achirální; začínají však chiralitu prezentovat, protože jejich H jsou nahrazeny R. Amin RdvaNH je achirální, pokud jsou dvě R různá. Postrádá však jakoukoli konfiguraci, která by odlišila jeden enantiomer od druhého (jako je tomu u chirálních uhlíkových center).
Je to proto, že enantiomery:
RdvaN-H | H-NRdva
směňují se takovým tempem, že se žádný z nich nedokáže izolovat; a proto jsou struktury aminů považovány za achirální, i když všechny substituenty na atomu dusíku jsou odlišné.
Vlastnosti aminů
Polarita
Aminy jsou polární sloučeniny, protože aminoskupina NHdva, tím, že má elektronegativní atom dusíku, přispívá k dipólovému momentu molekuly. Pamatujte, že dusík má schopnost darovat vodíkové vazby, což způsobuje, že aminy mají obecně vysoké teploty varu a teploty tání..
Pokud je však tato vlastnost porovnána s vlastnostmi okysličených sloučenin, jako jsou alkoholy a karboxylové kyseliny, vedou k nižším hodnotám..
Například teplota varu ethylaminu, CH3CHdvaNHdva (16,6 ° C) je nižší než u ethanolu, CH3CHdvaOH (78 ° C).
Je tedy prokázáno, že vodíkové vazby O-H jsou silnější než vazby N-H, i když amin může tvořit více než jeden můstek. Toto srovnání je platné pouze v případě, že R má stejnou molekulovou hmotnost pro obě sloučeniny (CH3CHdva-). Na druhé straně se ethan vaří při -89 ° C, CH3CH3, být plyn při pokojové teplotě.
Protože amin má méně vodíku, vytváří méně vodíkových vazeb a jeho teplota varu je snížena. To je patrné z porovnání bodu varu dimethylaminu (CH3)dvaNH (7 ° C), s obsahem ethylaminu (16,6 ° C).
Fyzikální vlastnosti
Ve světě chemie, když mluvíte o aminu, dochází k nedobrovolnému zadržování nosu. Je to proto, že mají obvykle nepříjemný zápach, z nichž některé připomínají shnilé ryby..
Kromě toho mají kapalné aminy tendenci mít nažloutlé tóny, což zvyšuje jejich vizuální nedůvěru..
Rozpustnost ve vodě
Aminy mají tendenci být nerozpustné ve vodě, protože i přes schopnost vytvářet vodíkové vazby s HdvaNebo je jeho hlavní organická složka hydrofobní. Čím větší nebo delší skupiny R, tím nižší je jejich rozpustnost ve vodě..
Pokud je v médiu kyselina, rozpustnost se zvyšuje tvorbou tzv. Aminových solí. V nich má dusík kladný částečný náboj, který elektrostaticky přitahuje anion nebo konjugovanou bázi kyseliny..
Například ve zředěném roztoku HCl je amin RNHdva reaguje následovně:
RNHdva + HCl => RNH3+Cl- (primární sůl aminu)
RNHdva Byl nerozpustný (nebo málo rozpustný) ve vodě a v přítomnosti kyseliny tvoří sůl, jejíž solvatace iontů podporuje její rozpustnost..
Proč se to stalo? Odpověď spočívá v jedné z hlavních vlastností aminů: jsou polární a základní. Jelikož jsou zásadité, budou reagovat s kyselinami dostatečně silnými na to, aby je protonovaly, podle definice Brönsted-Lowry..
Zásaditost
Aminy jsou silnější organické báze než amoniak. Čím vyšší je hustota elektronů kolem atomu dusíku, tím bude bazičtější; to znamená, že rychleji deprotonuje kyseliny v prostředí. Pokud je amin velmi zásaditý, může dokonce ukrást proton z alkoholů.
Skupiny R přispívají elektronovou hustotou k dusíku indukčním účinkem; protože nesmíme zapomenout, že je to jeden z nejvíce elektronegativních atomů v existenci. Pokud jsou tyto skupiny velmi dlouhé nebo objemné, indukční účinek bude větší, což také zvýší zápornou oblast kolem elektronového páru (··).
To způsobí (··) rychlejší přijetí iontu H+. Pokud jsou však R velmi objemné, bazicita se snižuje kvůli sterickému účinku. Proč? Z jednoduchého důvodu, že H+ musí dosáhnout konfigurace atomů, než dosáhne dusíku.
Dalším způsobem, jak uvažovat o zásaditosti aminu, je stabilizace jeho aminové soli. Ten, který klesá indukčním účinkem, nyní může snížit kladný náboj N+, bude to zásaditější amin. Důvody jsou stejné, právě vysvětleny.
Alkylaminy vs. arylaminy
Alkylaminy jsou mnohem bazičtější než arylaminy. Proč? Abychom to jednoduše pochopili, je ukázána struktura anilinu:
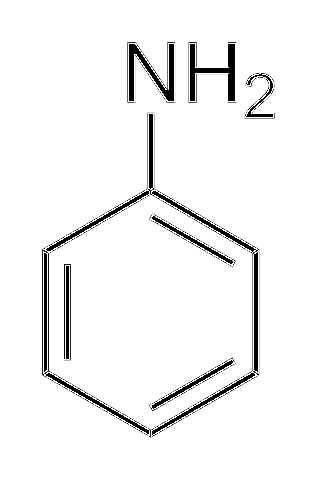
Nahoře v aminoskupině je dvojice elektronů (··). Tato dvojice „cestuje“ uvnitř prstence v orto a para poloze vzhledem k NHdva. To znamená, že dva horní vrcholy a protilehlé k NHdva jsou záporně nabité, zatímco atom dusíku kladně.
Protože je dusík kladně nabitý, +N, bude odpuzovat iont H+. A pokud to nestačí, elektronový pár se delokalizuje v aromatickém kruhu, čímž je méně přístupný deprotonátovým kyselinám..
Bazicita anilinu se může zvýšit, pokud jsou skupiny nebo atomy, které mu dávají elektronickou hustotu, spojeny s kruhem, soutěží s párem (··) a nutí jej lokalizovat s větší pravděpodobností na atomu dusíku, připraveného působit jako báze.
Typy (primární, sekundární, terciární)

I když to není formálně prezentováno, implicitně se odkazuje na primární, sekundární a terciární aminy (horní obrázek, zleva doprava).
Primární aminy (RNHdva) jsou monosubstituované; sekundární (RdvaNH), jsou disubstituované, dvěma R alkyl nebo aryl skupinami; a terciární (R.3N), jsou trisubstituovány a chybí mu vodík.
Všechny existující aminy jsou odvozeny z těchto tří typů, takže jejich rozmanitost a interakce s biologickou a neuronovou matricí jsou obrovské.
Obecně lze očekávat, že terciární aminy jsou nejzákladnější; Takové prohlášení však nelze učinit bez znalosti struktur R..
Výcvik
Alkylace amoniaku
Nejprve bylo zmíněno, že aminy jsou odvozeny od amoniaku; nejjednodušší způsob, jak je vytvořit, je tedy jejich alkylace. Za tímto účelem reaguje přebytek amoniaku s alkylhalogenidem, po kterém následuje přidání báze k neutralizaci aminové soli:
NH3 + RX => RNH3+X- => RNHdva
Tyto kroky vedou k primárnímu aminu. Mohou být také vytvořeny sekundární a dokonce terciární aminy, takže výtěžek jednoho produktu klesá.
Některé tréninkové metody, jako je Gabrielova syntéza, umožňují získat primární aminy, aby se netvořily další nežádoucí produkty.
Ketony a aldehydy lze také redukovat v přítomnosti amoniaku a primárních aminů, čímž vzniknou sekundární a terciární aminy..
Katalytická hydrogenace
Nitrosloučeniny lze redukovat v přítomnosti vodíku a katalyzátoru na jejich odpovídající aminy.
ArNOdva => ArNHdva
Nitrily, RC≡N a amidy, RCONRdva, jsou také redukovány za vzniku primárních a terciárních aminů.
Nomenklatura
Jak jsou pojmenovány aminy? Většinu času jsou pojmenovány na základě R, alkylové nebo arylové skupiny. K názvu R odvozenému od jeho alkanu se na konci přidává slovo „amin“.
CH3CHdvaCHdvaNHdva je propylamin. Na druhou stranu jej lze pojmenovat pouze s ohledem na alkan a ne jako skupinu R: propanamin.
První způsob jejich pojmenování je zdaleka nejznámější a nejpoužívanější.
Pokud existují dvě skupiny NHdva, je pojmenován alkan a jsou uvedeny polohy aminoskupin. HdvaNCHdvaCHdvaCHdvaCHdvaNHdva se nazývá: 1,4-butandiamin.
Pokud existují okysličené skupiny, jako je OH, měla by mít přednost před NHdva, který je náhodou pojmenován jako substituent. Například HOCHdvaCHdvaCHdvaNHdva Říká se tomu: 3-Aminopropanol.
A pokud jde o sekundární a terciární aminy, označují se skupiny R písmeny N. Nejdelší řetězec zůstane se jménem sloučeniny. Ch3NHCHdvaCH3 Říká se tomu: N-methylethylamin.
Aplikace
Barviva
Primární aromatické aminy mohou sloužit jako výchozí materiál pro syntézu azobarviv. Zpočátku aminy reagují za vzniku diazoniových solí, které tvoří azosloučeniny prostřednictvím azo vazby (nebo diazo vazby)..
Ty se díky svému intenzivnímu zabarvení používají v textilním průmyslu jako barvicí materiál; například: methyl oranžová, přímá hnědá 138, oranžová žlutá FCF a ponceau.
Drogy a drogy
Mnoho léků pracuje s agonisty a antagonisty přírodních aminových neurotransmiterů. Příklady:
-Chlorofeniramin je antihistaminikum používané při kontrole alergických procesů v důsledku požití některých potravin, senné rýmy, bodnutí hmyzem atd..
-Chlorpromazin je sedativum, nikoli látka vyvolávající spánek. Zmírňuje úzkost a používá se dokonce při léčbě některých duševních poruch.
-Efedrin a fenylefedrin se používají jako dekongestiva dýchacích cest.
-Amitriptylin a imipramin jsou terciární aminy, které se používají při léčbě deprese. Vzhledem ke své struktuře jsou klasifikovány jako tricyklická antidepresiva..
-Opioidní léky proti bolesti, jako je morfin, kodein a heroin, jsou terciární aminy.
Úprava plynu
Při eliminaci oxidu uhličitého (CO) se používá několik aminů, včetně diglykolaminu (DGA) a diethanolaminu (DEA)dva) a sirovodík (H.dvaS) přítomné v zemním plynu a rafinériích.
Zemědělská chemie
Methylaminy jsou meziprodukty při syntéze chemických látek, které se používají v zemědělství jako herbicidy, fungicidy, insekticidy a biocidy.
Výroba pryskyřice
Methylaminy se používají při výrobě iontoměničových pryskyřic použitelných při deionizaci vody.
Živočišné živiny
Trimethylamin (TMA) se používá především při výrobě cholinchloridu, doplňku vitaminu B používaného v krmivech pro kuřata, krůty a prasata..
Gumárenský průmysl
Dimethylaminooleát (DMA) je emulgátor používaný při výrobě syntetického kaučuku. DMA se používá přímo jako modifikátor polymerace v parní fázi butadienu a jako stabilizátor pro latex z přírodního kaučuku místo amoniaku
Rozpouštědla
Dimethylamin (DMA) a monomethylamin (MMA) se používají k syntéze aprotických polárních rozpouštědel dimethylformamidu (DMF), dimethylacetamidu (DMAc) a n-methylpyrrolidonu (NMP).
Aplikace pro DMF zahrnují: uretanový povlak, rozpouštědlo akrylové příze, reakční rozpouštědla a extrakční rozpouštědla.
DMAc se používá při výrobě barviv a rozpouštědel. Nakonec se NMP používá při rafinaci mazacích olejů, odstraňovačů nátěrů a smaltovaných povlaků..
Příklady
Kokain
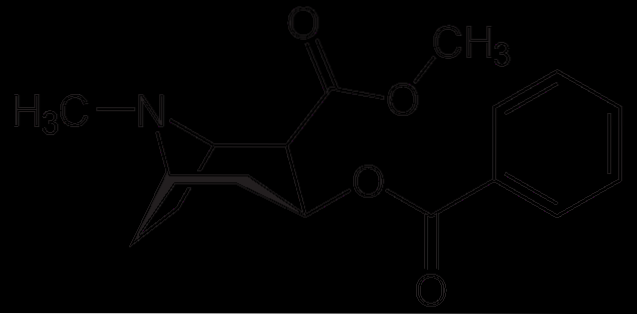
Kokain se používá jako lokální anestetikum při určitých typech operací očí, uší a krku. Jak je vidět, jedná se o terciární amin.
Nikotin

Nikotin je primárním činitelem závislosti na tabáku a chemicky je to terciární amin. Nikotin v tabákovém kouři se rychle vstřebává a je vysoce toxický.
Morfium
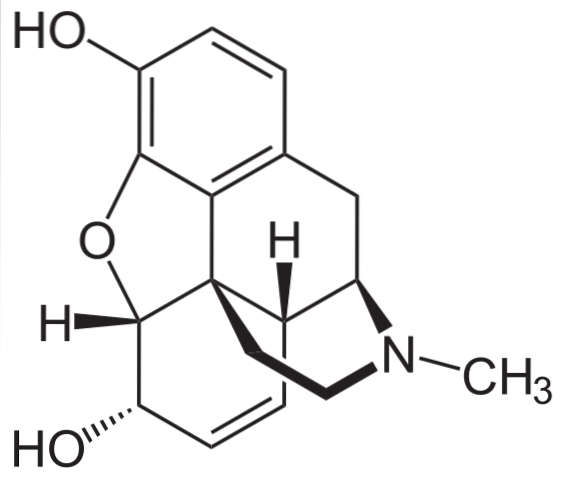
Je to jeden z nejúčinnějších prostředků k úlevě od bolesti ke zmírnění bolesti, zejména rakoviny. Je to opět terciární amin.
Serotonin

Serotonin je aminový neurotransmiter. U pacientů s depresí je koncentrace hlavního metabolitu serotoninu snížena. Na rozdíl od ostatních aminů je tento primární.
Reference
- Graham Solomons T.W., Craig B.Fryhle. (2011). Organická chemie. Miny. (10th edice.). Wiley plus.
- Carey F. (2008). Organická chemie. (Šesté vydání). Mc Graw Hill.
- Morrison a Boyd. (1987). Organická chemie. (Páté vydání). Addison-Wesley Iberoamericana.
- Společnost Chemours. (2018). Methylaminy: použití a aplikace. Obnoveno z: chemours.com
- Průzkum trhu s transparentností. (s.f.). Amines: důležitá fakta a použití. Obnoveno z: transparentnostmarketresearch.com
- Wikipedia. (2019). Amin. Obnoveno z: en.wikipedia.org
- Ganong, W. F. (2003). Lékařská fyziologie. 19. vydání. Redakce The Modern Manual.



Zatím žádné komentáře