
Tvorba aniontů, charakteristiky a typy
A anion Je to jakýkoli chemický druh se záporným nábojem, navíc je jedním ze dvou typů existujících iontů. Jeho záporný náboj pochází ze skutečnosti, že má přebytek elektronů ve srovnání s neutrální formou druhu; pro každý další elektron se jeho záporný náboj zvýší o jednu jednotku.
Záporný náboj může být lokalizován v jednom nebo více atomech a také zahrnovat jeho vliv na molekulu jako celek. Pro jednoduchost je bez ohledu na to, kde je náboj (-), celý druh, sloučenina nebo molekula považována za anion..
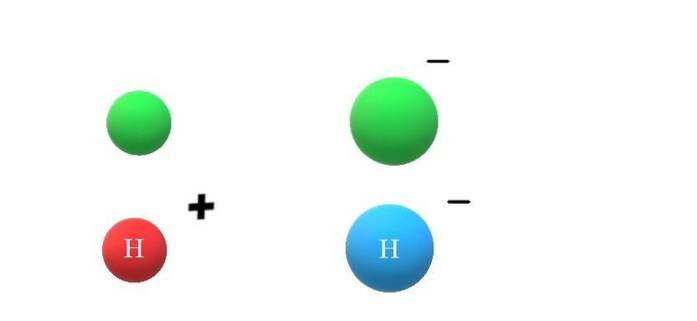
Pokud neutrální druh X získá elektron, nadměrné záporné náboje se projeví tvorbou aniontu X-, což také povede ke zvýšení jeho poloměru atomu (horní obrázek, zelené koule). X a X.- se enormně liší svými vlastnostmi a způsobem interakce s prostředím.
Pokud se nyní předpokládá, že X je atom H, může z něj například vzejít kation nebo anion: H+ nebo H-, resp. Kation H+ Je to vodíkový iont, nazývaný také proton; a H.- je hydridový anion, „nejjednodušší“ ze všech známých aniontů.
Rejstřík článků
- 1 Tvorba aniontu
- 1.1 Formální poplatky a méně odkazů
- 1.2 Snížení
- 1.3 Fyzika
- 2 Funkce
- 3 typy
- 3.1 Monatomické
- 3.2 Oxoaniony
- 3.3 Organické
- 3.4 Polyatomické
- 3.5 Molekulární nebo komplexní
- 4 Odkazy
Tvorba aniontu
Vznik aniontu lze snadno vysvětlit v teorii; Experimentálně to může být výzva, zvláště pokud to chcete čistě, bez kladných nábojů přitahovaných zápornými náboji..
Formální poplatky a méně odkazů
Anion se vytvoří, když je v atomu přebytek nebo zisk elektronů. Uvedený zisk lze určit využitím formálních nábojů v Lewisově struktuře. Pomocí předchozí metody také můžete přesně vědět, ze kterého atomu nebo skupiny z nich záporný náboj pochází.
Když atomy tvoří kovalentní vazby, může dojít k částečné ztrátě elektronů, i když je distribuce elektronů spravedlivá. V tomto smyslu platí, že čím méně vazeb, tím více elektronegativních atomů se vytvoří, tím více volných párů elektronů budou mít, a proto budou mít záporné náboje..
Zvažte například molekulu amoniaku, NH3. NH3 je neutrální, a proto nemá žádné elektrické náboje. Pokud by byl odstraněn H, to znamená, že byla přerušena vazba N-H, byl by získán anion NHdva-. Toto lze ověřit nakreslením jeho Lewisovy struktury a výpočtem formálního náboje N.
Po rozbití více N-H vazeb máme nyní NH aniondva-; a eliminací posledního H se konečně získá anion N.3-, nazývá se nitridový anion. Dusík již nemá způsob, jak získat více elektronů, a jeho -3 náboj je nejnegativnější, jaký může dosáhnout; jejich orbitaly nedávají více.
Snížení
Anion může být vytvořen v důsledku redukce: získává elektrony oxidací jiného druhu, který je ztrácí. Například kyslík představuje tento typ chemické reakce velmi dobře..
Když je kyslík redukován, oxiduje na jiný druh a stává se oxidovým aniontem, Odva-; přítomný v nesčetných minerálech a anorganických sloučeninách.
Fyzický
Atom může získat elektrony, pokud je v plynné fázi:
X (g) + e- => X-(G)
Tento způsob formování aniontu znamená široké znalosti fyzikálních technik, zatímco plynné anionty není snadné studovat, ani všechny druhy snadno těkají nebo atomizují do plynné fáze..
Vlastnosti
Obecně budou typické vlastnosti aniontu zmíněny níže, než budou diskutovány jejich typy a příklady:
-Je objemnější než neutrální atom, ze kterého je odvozen.
-Může být víceméně stabilní, navzdory rostoucímu elektronickému odporu mezi svými vlastními elektrony.
-Pokud anion pochází z nízkého elektronegativního atomu, jako je uhlík, je velmi reaktivní.
-Vytvořte silné dipólové momenty.
-Dále zvyšuje jeho interakci s polárními rozpouštědly.
-Monatomický anion je izoelektronický vůči vzácnému plynu své doby; to znamená, že má ve valenčním plášti stejný počet elektronů.
-Může polarizovat elektronový mrak sousedního atomu a odpuzovat jeho vnější elektrony.
Typy
Monatomické
Jak název napovídá, jedná se o anion, který se skládá z jediného atomu: záporný náboj je dobře umístěn. Každá skupina v periodické tabulce má charakteristické záporné náboje; a protože jsou to anionty, jsou to nekovy umístěné v p bloku. Některé příklady a jejich názvy jsou uvedeny níže:
-Cl-, chlorid.
-Já-, Já vydržím.
-F-, fluorid.
-Br-, bromid.
-NEBOdva-, kysličník.
-Sdva-, sulfid.
-vímdva-, selenid.
-Čajdva-, telurid.
-Podva-, poloniur.
-N3-, nitrid.
-P3-, fosfid.
-Eso3-, arzenid.
-Sb3-, antimoniuro.
-C4-, karbid.
-Ano4-, silicid.
-B3-, boruro.
Oxoaniony
Oxoanionty se vyznačují tím, že mají vazbu X = O, kde X může být jakýkoli nekovový prvek (kromě fluoru) nebo kov (chrom, mangan atd.). Mohou mít také jeden nebo více jednoduchých odkazů X-O.
Některé oxoaniony s příslušnými názvy jsou:
-ClO-, chlornan.
-BrO-, hypobromit.
-IO-, hypoiodit.
-ClOdva-, chloritan.
-ClO3-, chlorát.
-IO3-, jodičnan.
-ClO4-, chloristan.
-PO43-, fosfát.
-CO3dva-, uhličitan.
-CrO4dva-, chromát.
-CrdvaNEBO7dva-, dichroman.
-SW4dva-, síran.
-SdvaNEBO3dva-, thiosíran.
-NE3-, dusičnan.
-NEdva-, dusitany.
-BO33-, borát.
-AsO43-, arzeničnan.
-PO33-, fosfit.
-MnO4-, manganistan.
Organické
Organické molekuly mají funkční skupiny, které se mohou elektricky nabít. Jak? Tvorbou nebo rozbitím kovalentních vazeb, velmi podobné příkladu molekuly NH3.
Některé organické anionty jsou:
-CH3VRKAT-, acetát.
-HCOO-, Formát.
-CdvaNEBO4dva-, šťavelan.
-RCOO-, karboxylát.
-CH3CONH-, amidovat.
-RO-, alkoxid.
-R3C-, karbanion.
-CH3NEBO-, methoxid.
Polyatomické
Oxoaniony jsou také polyatomové anionty, to znamená, že se skládají z více než jednoho atomu. Totéž se děje s organickými anionty. Polyatomika však nespadá do žádné z výše uvedených klasifikací. Někteří z nich jsou:
-CN-, kyanid (má trojnou vazbu, C≡N).
-OCN-, kyanát.
-SCN-, thiokyanát.
-NHdva-, Amide.
-Ach-, hydroxyl, hydroxid nebo hydroxyl.
-NEBOdva-, superoxid.
-NEBOdvadva-, peroxid.
Molekulární nebo komplexní
V organických aniontech byly zmíněny některé záporně nabité funkční skupiny. Tyto skupiny mohou být součástí velké molekuly, a tak může být anion celá robustní sloučenina s mnoha vazbami. Nejjednodušší z tohoto typu aniontů je hypotetická molekula Hdva-.
Dalším příkladem těchto aniontů jsou polysulfidy, Sndva-, které se skládají z řetězců s více vazbami S-S. Také negativně nabité kovové koordinační sloučeniny, jako je [CoCl4(NH3)dva]- a [CuCl4]dva-.
Reference
- Whitten, Davis, Peck a Stanley. (2008). Chemie. (8. vydání). Učení CENGAGE.
- Wikipedia. (2019). Anion. Obnoveno z: es.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (21. března 2019). Tabulka běžných aniontů a seznam vzorců. Obnoveno z: thoughtco.com
- Nadace CK-12. (2016, 29. června). Tvorba aniontů. Chemistry LibreTexts. Obnoveno z: chem.libretexts.org
- Francis E. (2002). Anionty. Clackamas Community College. Obnoveno z: dl.clackamas.edu
- Americká fyzická společnost. (3. listopadu 2011). Synopse: Nejjednodušší molekulární anion. Obnoveno z: physics.aps.org



Zatím žádné komentáře