
Historie benzenu, struktura, vlastnosti, deriváty, použití
The benzen Je to organická sloučenina, která se skládá z jednoho z nejjednodušších aromatických uhlovodíků ze všech. Jeho chemický vzorec je C.6H6, z nichž je známo, že poměr mezi uhlíkem a vodíkem je roven 1; to znamená, že pro každý uhlík je na něj vázán vodík.
Ačkoli má fyzický vzhled bezbarvé kapaliny, přirozeně se nachází v ropě a ropných produktech. Jeho vůně je velmi charakteristická, protože připomíná směs lepidla, bitumenu a benzínu; na druhé straně je to těkavá a hořlavá kapalina.

Obrázek výše ukazuje nádobu nebo láhev s benzenem, pravděpodobně neanalytické čistoty. Pokud by se odkryly, páry benzenu by se okamžitě rozšířily po celé laboratoři. Z tohoto důvodu se s touto kapalinou, běžně používanou jako jednoduché rozpouštědlo, zachází uvnitř digestoře..
Být jeho vzorec C.6H6, chemici 19. století navrhli řadu možných struktur, které by odpovídaly uvedenému poměru C / H rovnému 1. Nejen to, ale molekula benzenu musela mít speciální vazby takovým způsobem, aby bylo možné vysvětlit její neobvyklou stabilitu proti adičním reakcím; typické pro alkeny a polyeny.
Bylo to tedy tak, že jejich vazby představovaly záhadu pro chemiky té doby; dokud vlastnost nezavolala aromatičnost. Předtím, než je benzen považován za hexacyklotrien (se třemi vazbami C = C), je mnohem víc než jen to, a je dalším z mnoha příkladů synergie v chemii.
V organické chemii je benzen klasickým symbolem, strukturálním základem pro více polyaromatických sloučenin. Nekonečné deriváty se získávají z jeho šestiúhelníku aromatickou elektrofilní substitucí; prsten, z jehož okrajů je utkaná struktura, která definuje nové sloučeniny.
Ve skutečnosti jsou jeho deriváty způsobeny rozsáhlým průmyslovým využitím, pro něž jako surovinu potřebují benzen. Od přípravy lepidel a textilních vláken až po plasty, gumy, pigmenty, léky a výbušniny. Na druhou stranu se benzen přirozeně vyskytuje v sopkách, lesních požárech, benzínu a v cigaretovém kouři..
Rejstřík článků
- 1 Historie
- 1.1 Objev a jména
- 1.2 Průmyslová výroba
- 1.3 Historické struktury
- 2 Struktura benzenu
- 2.1 Rezonance
- 2.2 Krystaly
- 3 Vlastnosti
- 3.1 Molekulová hmotnost
- 3.2 Fyzický vzhled
- 3.3 Bod varu
- 3.4 Bod tání
- 3.5 Bod vzplanutí
- 3.6 Teplota samovznícení
- 3.7 Hustota
- 3.8 Rozpustnost
- 3.9 Hustota par
- 3.10 Tlak par
- 3.11 Spalné teplo
- 3.12 Odpařovací teplo
- 3.13 povrchové napětí
- 3.14 Index lomu
- 4 Deriváty
- 5 použití
- 6 Názvosloví
- 7 Toxicita
- 8 Reference
Příběh
Objev a jména
Jeho objev se datuje do roku 1825, obvykle přisuzovaný Michaelovi Faradayovi, když sbíral a experimentoval se zbývajícím ropným produktem plynu používaného k osvětlení. Tato kapalina obsahovala poměr C / H blízký 1, proto ji nazval „karburovaný vodík“.
Chemik Auguste Laurent pojmenoval podivný uhlovodík „feno“ odvozený z řeckého slova „phainein„což znamená jasný (protože byl získán po spálení plynu). Tento název však nebyl vědeckou komunitou akceptován a převažoval pouze jako „fenyl“, což znamená radikál odvozený od benzenu.
Z benzoinové gumy se chemikovi Eilhardovi Mitscherlichovi o devět let později podařilo vyrobit stejnou sloučeninu; Proto existoval další zdroj téhož uhlovodíku, který pokřtil jako „benzín“. Nezvažovali však ani vhodný název za předpokladu, že se jedná o alkaloid, jako je chinin..
Název „benzin“ tedy nahradili výrazem „benzol“. Opět však došlo k rozporům a nesrovnalostem v důsledku termínu „benzol“, který zaměňoval uhlovodík za alkohol. Tehdy se zrodil název „benzen“, který se poprvé používal ve Francii a Anglii..
Průmyslová produkce
Ani osvětlovací plyn, ani benzoinová guma nebyly vhodnými zdroji pro generování benzenu ve velkém měřítku. Charles Mansfield ve spolupráci s Augustem Wilhelmem von Hofmannem se podařilo v roce 1845 izolovat benzen (dvacet let po jeho objevení) z černouhelného dehtu, vedlejšího produktu při výrobě koksu..
Takto začala průmyslová výroba benzenu z černouhelného dehtu. Dostupnost benzenu v obrovských množstvích usnadnila studium jeho chemických vlastností a umožnila jeho příbuznost s jinými sloučeninami s podobnými reaktivitami. Sám August Wilhelm von Hofmann vytvořil slovo „aromatický“ pro benzen a příbuzné sloučeniny.
Historické struktury
Sen Augusta Kekulé
Friedrichu Augustu Kekulému je přičítána hexagonální a cyklická struktura benzenu kolem roku 1865, vyplývající ze zvláštního snu s Uroborosem, hadem, který si kouše svůj vlastní ocas nakreslením kruhu. Věřil tedy, že benzen lze považovat za šestihranný kruh, a další chemici navrhli možné struktury, které jsou uvedeny níže:

Některé z vyšších struktur by mohly odpovídat za stabilitu benzenu.
Kniha, prsteny a hranol
Všimněte si, že třetí struktura není ani prsten, ale trojúhelníkový hranol, který navrhl Albert Ladenburg v roce 1869; nalevo, jedna ve tvaru otevřené knihy, kterou navrhl sir James Dewar v roce 1867; a napravo jeden se všemi vodíky směřujícími do středu prstence, navržený Henrym Edwardem Armstrongem v roce 1887.
První struktura, navržená Adolfem Karlem Ludwigem Clausem v roce 1867, je také docela zvláštní, protože jsou vzájemně propojeny vazby CC. A poslední byl Kekulého „hadovitý“ prsten, o kterém se snilo v roce 1865.
Jaký byl „vítěz“? Pátá stavba (zleva doprava), kterou v roce 1899 navrhl Johannes Thiele.
V této studii byl poprvé uvažován rezonanční hybrid, který kombinoval dvě struktury Kekulé (otočte první prsten doprava, abyste jej pozorovali) a mimořádně vysvětlil delokalizaci elektronů a s ní do té doby neobvyklou stabilitu benzen.
Struktura benzenu
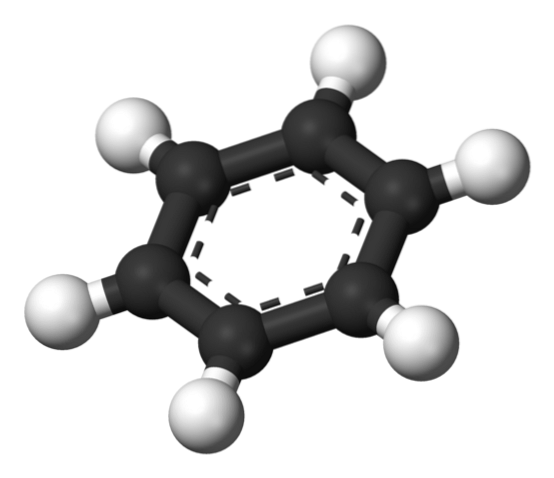
Nahoře je struktura navržená Thiele pomocí modelu koulí a tyčí..
Molekula benzenu je plochá, přičemž atomy vodíku směřují ven ze stran kruhu. Všechny atomy uhlíku mají sp hybridizacidva, s orbitálem p k dispozici pro stanovení aromatického systému, ve kterém se přemístí šest elektronů.
Tyto uhlíky spdva jsou více elektronegativní než vodíky, a proto první odebírají elektronovou hustotu druhému (Csp2δ--Hδ+). Následkem toho má střed prstence vyšší koncentraci elektronů než jeho strany..
Přesněji, aromatický systém může být reprezentován jako elektronický mrak nebo polštář rozšířený na obou stranách šestihranného kruhu; a uprostřed, po stranách nebo na okrajích, elektronický nedostatek tvořený vodíky s kladným částečným nábojem.
Díky této distribuci elektrických nábojů mohou molekuly benzenu vzájemně interagovat prostřednictvím dipól-dipólových sil; Atomy vodíkuδ+ jsou přitahovány ke středu vůně sousedního prstenu (toto bude znázorněno níže).
Aromatická centra lze také skládat na sebe, aby se podpořila indukce okamžitých dipólů..
Rezonance

Dvě struktury Kekulé jsou zobrazeny v horní části obrázku a pod nimi rezonanční hybrid. Jelikož se obě struktury vyskytují znovu a znovu ve stejnou dobu, hybrid je reprezentován kruhem nakresleným uprostřed (podobně jako u „šestiúhelníkového prstence“).
Hybridní kruh je důležitý, protože označuje aromatický charakter benzenu (a mnoha dalších sloučenin). Dále zdůrazňuje, že odkazy nejsou tak dlouhé jako C-C, ani nejsou tak krátké jako C = C; ale jeho délka je mezi oběma extrémy. Benzen tedy není považován za polyen.
Výše uvedené bylo prokázáno měřením délek vazeb C-C (139 pm) benzenu, které jsou o něco protáhlejší než vazby CH (109 pm).
Krystaly
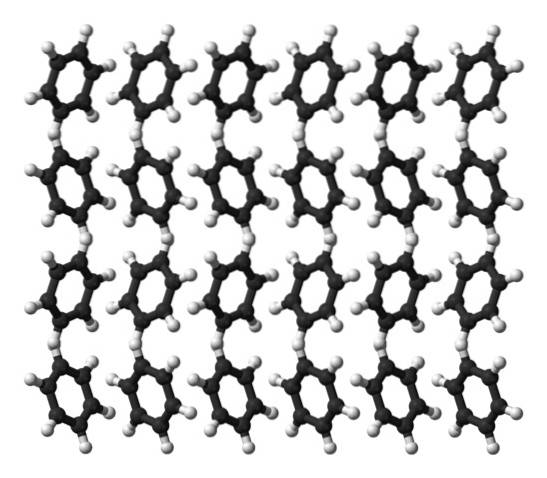
Benzen je kapalina při pokojové teplotě. Jeho mezimolekulární síly znamenají, že i když nemá tak výrazný dipólový moment, může držet své molekuly pohromadě v kapalině, která se vaří při 80 ° C. Když teplota klesne pod 5 ° C, benzen začne zmrznout: a tak se získají jeho odpovídající krystaly..
Benzenové kruhy mohou přijmout definované strukturní vzory ve své pevné látce. Jejich dipóly způsobují, že se „naklánějí“ doleva nebo doprava a vytvářejí řady, které lze reprodukovat ortorombickou jednotkovou buňkou. Krystaly benzenu jsou tedy ortorombické.
V horním obrázku si všimněte, že naklonění prstenů upřednostňuje interakce mezi Hδ+ a aromatická centra uvedená v předchozích pododdílech.
Vlastnosti
Molekulová hmotnost
78,114 g / mol.
Fyzický vzhled
Bezbarvá kapalina s benzínovým zápachem.
Bod varu
80 ° C.
Bod tání
5,5 ° C.
bod vznícení
-11 ° C (uzavřený kelímek).
Teplota samovznícení
497,78 ° C.
Hustota
0,8765 g / ml při 20 ° C.
Rozpustnost
Jeden litr vroucí vody sotva rozpustí 3,94 g benzenu. Díky svému nepolárnímu charakteru je prakticky nemísitelný s vodou. Je však mísitelný s jinými rozpouštědly, jako je ethanol, ethery, aceton, oleje, chloroform, tetrachlormethan atd..
Hustota par
2,8 vzhledem ke vzduchu (tj. Téměř třikrát hustší).
Tlak páry
94,8 mm Hg při 25 ° C.
Spalné teplo
-3267,6 kJ / mol (pro kapalný benzen).
Odpařovací teplo
33,83 kJ / mol.
Povrchové napětí
28,22 mN / m při 25 ° C.
Index lomu
1,5011 při 20 ° C.
Deriváty
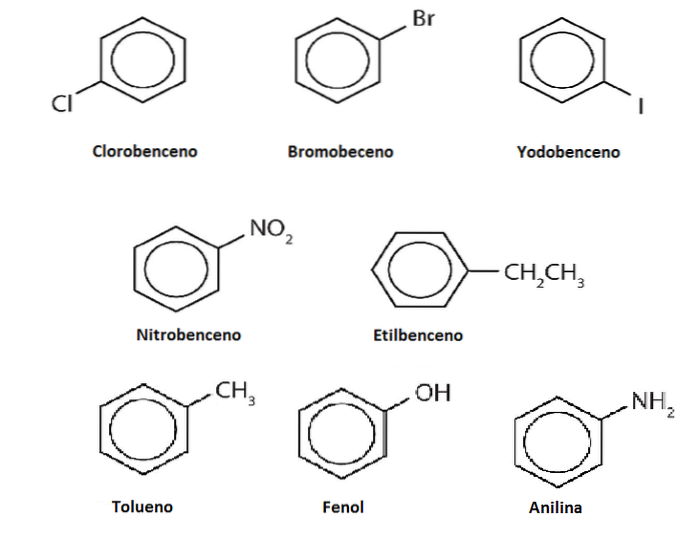
Vodíky benzenu mohou být nahrazeny jinými skupinami nebo atomy. Může existovat jedna nebo více substitucí, které zvyšují stupeň substituce, dokud nezůstane žádný z původních šesti vodíků.
Například předpokládejme benzen jako Ph-H, kde H je kterýkoli z jeho šesti vodíků. Pamatujte, že střed kruhu má vyšší elektronovou hustotu, přitahuje elektrofily, které napadají kruh a nahrazují H v reakci zvané elektrofilní aromatická substituce (SEAr).
Pokud je toto H nahrazeno OH, budeme mít Ph-OH, fenol; nahrazen CH3, Ph-CH3, toluen; pokud je to NHdva, Ph-NHdva, anilin; nebo pokud je to CHdvaCH3, Ph-CHdvaCH3, ethylbenzen.
Deriváty mohou být stejné nebo toxičtější než benzen, nebo naopak mohou být tak složité, že mají požadovaný farmakologický účinek..
Aplikace
Je dobrým rozpouštědlem pro širokou škálu sloučenin přítomných například v barvách, lacích, lepidlech a nátěrech.
Může také rozpouštět oleje, tuky nebo vosky, a proto se používá jako extrakční rozpouštědlo pro esence. Tuto vlastnost začal používat Ludwig Roselius v roce 1903 k dekofeinování kávy, což je operace, která se již nepoužívá kvůli toxicitě benzenu. Podobně se v minulosti používal k odmašťování kovů.
V jednom ze svých klasických použití nepůsobí jako rozpouštědlo, ale jako přísada: zvyšuje oktanové číslo benzínu a za tímto účelem nahrazuje olovo..
Deriváty benzenu mohou mít různá použití; některé slouží jako pesticidy, maziva, čisticí prostředky, plasty, výbušniny, parfémy, barviva, lepidla, léky atd. Pokud je ve struktuře pozorován benzenový kruh, je docela pravděpodobné, že jeho syntéza začala z benzenu.
Mezi jeho nejdůležitější deriváty patří: kumen, xylen, anilin, fenol (pro syntézu fenolových pryskyřic), kyselina benzoová (konzervační látka), cyklohexan (pro syntézu nylonu), nitrobenzen, resorcinol a ethylbenzen.
Nomenklatura
Názvosloví benzenových derivátů se liší v závislosti na stupni substituce, jaké jsou skupiny substituentů a jejich relativních polohách. Benzen tedy může být substituován mono, di, tri, tetra atd
Pokud jsou obě skupiny připojeny k sousedním uhlíkům, použije se označení „ortho“; pokud je mezi jejich oddělením uhlík, „meta“; a pokud jsou uhlíky v opačných polohách, 'para'.
Na obrázcích níže jsou uvedeny příklady benzenových derivátů s příslušnými názvy podle IUPAC. Jsou také doprovázeny běžnými nebo tradičními jmény.
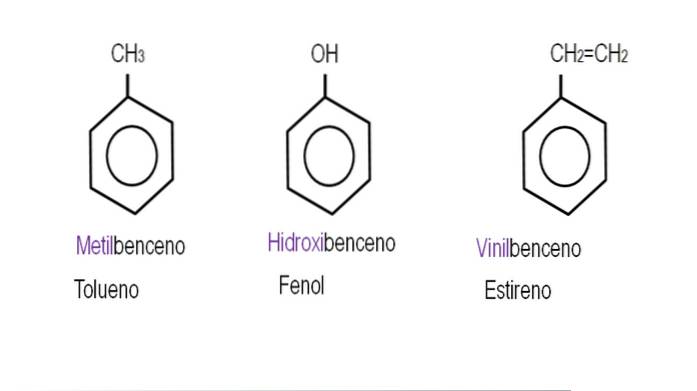
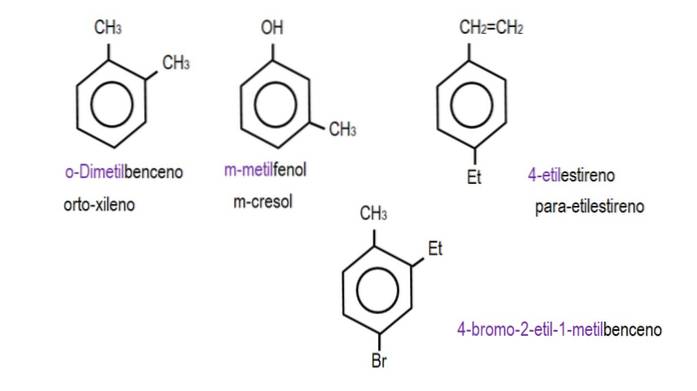
Všimněte si, že v trisubstituovaném benzenu již nejsou orto, para a meta indikátory užitečné..
Toxicita
Benzen je sloučenina, se kterou je třeba zacházet opatrně. Vzhledem k jeho zvláštní vůni mohou být okamžitými negativními účinky dusení, závratě, bolesti hlavy, třes, ospalost, nevolnost a dokonce smrt (při vysoké expozici). Při požití může kromě výše uvedeného způsobit silné bolesti žaludku a záchvaty..
Kromě toho jsou dlouhodobé účinky při stálém vystavení této kapalině karcinogenní; zvyšuje pravděpodobnost, že jedinec bude trpět nějakým typem rakoviny, zejména rakovinou krve: leukémií.
V krvi může snížit koncentraci červených krvinek, způsobit anémii a také ovlivnit kostní dřeň a játra, kde je tělem asimilováno za vzniku ještě toxičtějších benzenových derivátů; například hydroxychinon. Hromadí se také v ledvinách, srdci, plicích a mozku..
Reference
- Morrison, R.T. a Boyd, R. N. (1987). Organická chemie. (5. vydání). Addison-Wesley Iberoamericana.
- Carey, F. A. (2008). Organická chemie. (6. vydání). McGraw-Hill, Interamerica, Editores S.A.
- Graham Solomons T.W., Craig B.Fryhle. (2011). Organická chemie. Miny. (10. vydání.). Wiley plus.
- Národní centrum pro biotechnologické informace. (2019). Benzen. Databáze PubChem. CID = 241, obnoveno z: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2019). Benzen. Obnoveno z: en.wikipedia.org
- García Nissa. (2019). Co je benzen? - Použití, struktura a vzorec. Studie. Obnoveno z: study.com
- Centra pro kontrolu a prevenci nemocí. (4. dubna 2018). Fakta o benzenu. Obnoveno z: emergency.cdc.gov
- Světová zdravotnická organizace. (2010). Vystavení benzenu: hlavní problém veřejného zdraví. [PDF]. Obnoveno z: who.int
- Fernández Germán. (s.f.). Problémy s nomenklaturou benzenu. Organická chemie. Obnoveno z: quimicaorganica.org



Zatím žádné komentáře