
Benzylbenzyl vodíky, karbokationty, benzylové radikály
The benzyl nebo benzyl je běžná skupina substituentů v organické chemii, jejíž vzorec je C6H5CHdva- nebo Bn-. Strukturálně to sestává jednoduše ze spojení methylenové skupiny, CHdva, s fenylovou skupinou, C6H5; to je uhlík sp3 přímo vázaný na benzenový kruh.
Na benzylovou skupinu lze tedy pohlížet jako na aromatický kruh připojený k malému řetězci. V některých textech je místo C upřednostňováno použití zkratky Bn6H5CHdva-, být snadno rozpoznatelný v jakékoli sloučenině; zvláště když je připojen k atomu kyslíku nebo dusíku, O-Bn nebo NBndva, resp.

Tato skupina se také implicitně nachází v řadě široce známých sloučenin. Například na kyselinu benzoovou, C6H5COOH, lze považovat za benzyl, jehož uhlík sp3 prošlo rozsáhlou oxidací; nebo benzaldehyd, C6H5CHO, z částečné oxidace; a benzylalkohol, C6H5CHdvaOH, ještě méně rezavý.
Další poněkud zřejmý příklad této skupiny lze nalézt v toluenu, C6H5CH3, které mohou podstoupit určitý počet reakcí v důsledku neobvyklé stability způsobené benzylovými radikály nebo karbokationty. Benzylová skupina však slouží k ochraně skupin OH nebo NH.dva reakcí, které nežádoucím způsobem modifikují produkt, který má být syntetizován.
Rejstřík článků
- 1 Příklady sloučenin s benzylovou skupinou
- 2 Benzylové vodíky
- 3 Karbokace a benzylové radikály
- 3.1 Rezonance v benzylové skupině
- 3.2 Ostatní radikály
- 4 Reakce
- 5 Reference
Příklady sloučenin s benzylovou skupinou
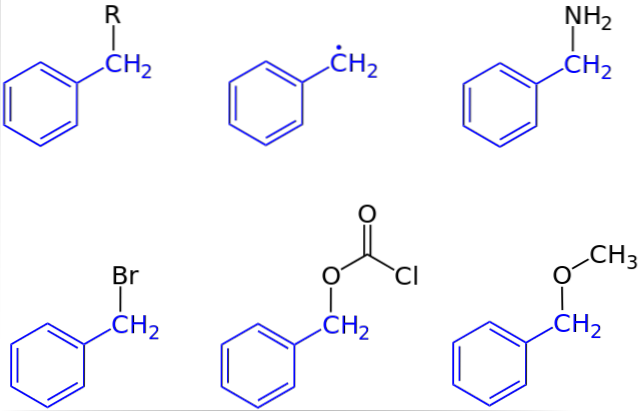
Na prvním obrázku byla ukázána obecná reprezentace sloučeniny s benzylovou skupinou: C6H5CHdva-R, kde R může být jakýkoli jiný molekulární fragment nebo atom. Tudíž změnou R lze získat vysoký počet příkladů; některé jednoduché, jiné pouze pro konkrétní oblast větší struktury nebo množiny.
Například benzylalkohol je odvozen ze substituce OH za R: C6H5CHdva-ACH. Pokud je místo OH skupina NHdva, potom vzniká sloučenina benzylaminu: C6H5CHdva-NHdva.
Pokud Br je atom, který nahradí R, výslednou sloučeninou je benzylbromid: C6H5CHdva-Br; R pro COdvaCl vede k esteru, benzylchlorkarbonátu (nebo karbobenzoxylchloridu); a OCH3 poskytuje benzylmethylether, C6H5CHdva-OCH3.
Dokonce (i když ne zcela správně) lze R předpokládat osamělým elektronem: benzylovým radikálem C6H5CHdva· Produkt osvobození radikálu R ·. Dalším příkladem, i když není zahrnut do obrázku, je fenylacetonitril nebo benzylkyanid, C.6H5CHdva-CN.
Existují sloučeniny, kde benzylová skupina sotva představuje určitou oblast. V tomto případě se zkratka Bn často používá ke zjednodušení struktury a jejích ilustrací..
Benzylové vodíky
Výše uvedené sloučeniny mají společné nejen aromatický nebo fenylový kruh, ale také benzylové vodíky; to jsou ty, které patří do sp uhlíku3.
Takové vodíky lze představovat jako: Bn-CH3, Bn-CHdvaR nebo Bn-CHRdva. Sloučenina Bn-CR3 postrádá benzyl vodík, a proto je jeho reaktivita menší než u ostatních.
Tyto vodíky se liší od těch, které jsou obvykle připojeny k sp uhlíku3.
Zvažte například metan, CH4, který lze také napsat jako CH3-H. Aby se rozbila vazba CH3-H při heterolytickém rozkladu (tvorba radikálů) musí být dodáno určité množství energie (104 kJ / mol).
Energie pro stejnou vazbu C se však rozbije6H5CHdva-H je nižší ve srovnání s methanem (85 kJ / mol). Jelikož je této energie méně, znamená to, že radikál C.6H5CHdvaJe stabilnější než CH3·. Totéž se ve větší či menší míře děje s jinými benzylovými vodíky.
V důsledku toho jsou benzylové vodíky reaktivnější při vytváření stabilnějších radikálů nebo karbokationtů než ty, které jsou způsobeny jinými vodíky. Proč? Otázka je zodpovězena v další části.
Carbocations a benzylové radikály
O radikálním C se už uvažovalo6H5CHdva·, Nedostatek benzylkarbokace: C6H5CHdva+. V první je osamělý nepárový elektron a ve druhé elektronický nedostatek. Tyto dva druhy jsou velmi reaktivní a představují přechodné sloučeniny, z nichž pocházejí konečné produkty reakce..
Carbon sp3, po ztrátě jednoho nebo dvou elektronů za vzniku radikálu, respektive karbokace, může přijmout sp hybridizacidva (trigonální rovina), a to takovým způsobem, aby mezi jeho elektronickými skupinami bylo co nejméně možné odpuzování. Pokud se však stane, že je spdva, Může dojít stejně jako atomy uhlíku na aromatickém kruhu ke konjugaci? Odpověď je ano.
Rezonance v benzylové skupině
Tato konjugace nebo rezonance je klíčovým faktorem pro vysvětlení stability těchto benzylů nebo druhů odvozených z benzylu. Následující obrázek ilustruje takový jev:
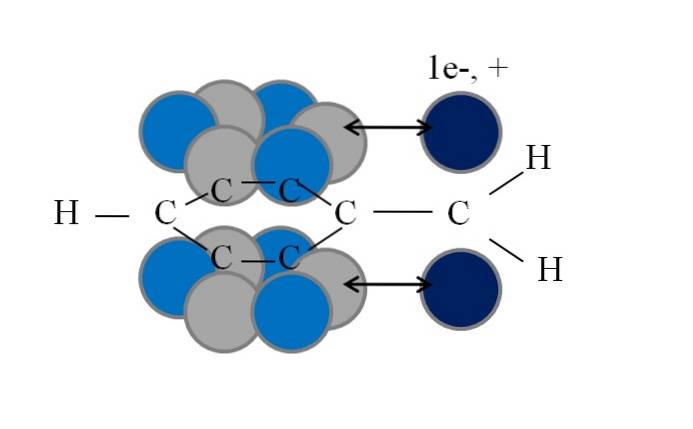
Všimněte si, že tam, kde byl jeden z benzylových vodíků, zůstal orbitál p s nepárovým elektronem (radikál, 1e-), nebo neplatné (karbokation, +). Jak je vidět, tento orbitál p je rovnoběžná s aromatickým systémem (šedé a světle modré kruhy), přičemž dvojitá šipka označuje začátek konjugace.
Nepárový elektron i kladný náboj tedy mohou být přeneseny nebo rozptýleny aromatickým kruhem, protože jeho geometrie upřednostňuje rovnoběžnost jejich orbitalů. Ty však nespočívají na žádném orbitálu p aromatický kruh; pouze v těch, které patří k uhlíkům v orto a para poloze vzhledem k CHdva.
Proto nad modrými kruhy vystupují světle modré kruhy: v nich je soustředěna negativní nebo pozitivní hustota radikálu nebo karbokationtu..
Ostatní radikály
Je třeba zmínit, že tato konjugace nebo rezonance nemůže nastat u uhlíků sp3 nejvzdálenější od aromatického kruhu.
Například radikál C.6H5CHdvaCHdvaJe mnohem nestabilnější, protože nepárový elektron nemůže konjugovat s prstencem, když zasáhne skupina CHdva mezi a se sp hybridizací3. Totéž platí pro C.6H5CHdvaCHdva+.
Reakce
Stručně shrnuto: benzylové vodíky jsou náchylné k reakci, buď za vzniku radikálu, nebo karbokationtu, který zase vede k výslednému produktu reakce. Reagují tedy prostřednictvím mechanismu SN.1.
Příkladem je bromace toluenu pod ultrafialovým zářením:
C6H5CH3 + 1/2 Brdva => C.6H5CHdvaBr
C6H5CHdvaBr + 1 / 2Brdva => C.6H5CHBrdva
C6H5CHBrdva + 1/2 Brdva => C.6H5CBr3
Ve skutečnosti se při této reakci produkují radikály Br..
Na druhou stranu samotná benzylová skupina reaguje na ochranu skupin OH nebo NH.dva v jednoduché substituční reakci. Alkohol ROH lze tedy „benzylovat“ pomocí benzylbromidu a dalších činidel (KOH nebo NaH):
ROH + BnBr => ROBn + HBr
ROBn je benzylether, kterému může být vrácena jeho původní OH skupina, pokud je vystavena redukčnímu médiu. Tento ether by měl zůstat nezměněn, zatímco na sloučenině probíhají další reakce..
Reference
- Morrison, R.T. a Boyd, R. N. (1987). Organická chemie. (5. vydání). Addison-Wesley Iberoamericana.
- Carey, F. A. (2008). Organická chemie. (6. vydání). McGraw-Hill, Interamerica, Editores S.A.
- Graham Solomons T.W., Craig B.Fryhle. (2011). Organická chemie. Miny. (10. vydání.). Wiley plus.
- Wikipedia. (2019). Benzylová skupina. Obnoveno z: en.wikipedia.org
- Dr. Donald L. Robertson. (5. prosince 2010). Fenyl nebo benzyl? Obnoveno z: home.miracosta.edu
- Gamini Gunawardena. (2015, 12. října). Benzylová karbokace. Chemistry LibreTexts. Obnoveno z: chem.libretexts.org



Zatím žádné komentáře