
Butanální struktura, vlastnosti, použití a rizika
The butanal je to aldehyd s otevřeným řetězcem, který se skládá ze čtyř atomů uhlíku a je analogický butanu; je to ve skutečnosti druhá nejvíce oxidovaná forma uhlovodíkového butanu po kyselině máselné. Jeho molekulární vzorec je CH3CHdvaCHdvaCHO, kde -CHO je formylová skupina.
Tento aldehyd, jeden z nejlehčích, se skládá z průhledné, hořlavé kapaliny, která je méně hustá než voda. Kromě toho je rozpustný ve vodě a mísitelný s většinou organických rozpouštědel; proto jej lze použít pro jednofázové organické směsi.
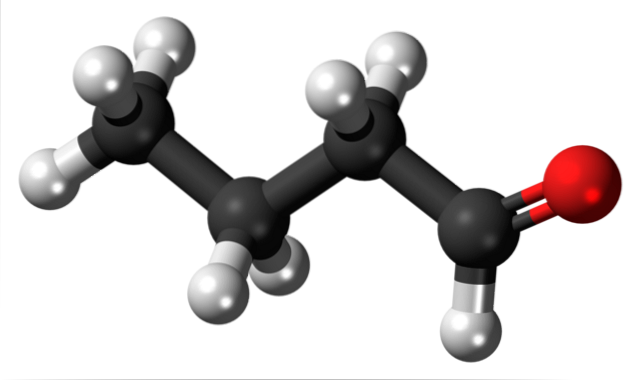
Přítomnost karbonylové skupiny (červená koule, horní obrázek) dává chemickou polaritu molekule butanalu, a tedy schopnost zažít interakci dipól-dipól mezi jeho molekulami; i když se mezi nimi netvoří vodíkové vazby.
To má za následek, že butanal má vyšší teploty varu a teploty tání než butan, ale nižší než ty, které představují n-butylalkohol..
Butanal se používá jako rozpouštědlo a je meziproduktem k získání mnoha produktů; jako jsou urychlovače vulkanizace pro kaučuky, pryskyřice, farmaceutika a agrochemikálie.
Butanal je toxická sloučenina, která při vdechování může způsobit zánět horních cest dýchacích, průdušek a plicní edém, který může mít dokonce fatální následky.
Rejstřík článků
- 1 Struktura butanalu
- 1.1 Konformátoři
- 2 Vlastnosti
- 2.1 Chemické názvy
- 2.2 Molekulární vzorec
- 2.3 Fyzický vzhled
- 2.4 Zápach
- 2.5 Bod varu
- 2.6 Teplota tání
- 2.7 Bod vzplanutí
- 2.8 Rozpustnost ve vodě
- 2.9 Rozpustnost v organických rozpouštědlech
- 2.10 Hustota
- 2.11 Hustota par
- 2.12 Tlak par
- 2.13 Automatické zapalování
- 2.14 Viskozita
- 2.15 Spalné teplo
- 2.16 Odpařovací teplo
- 2.17 Povrchové napětí
- 2.18 Prahová hodnota zápachu
- 2.19 Index lomu
- 2.20 Dipólový moment
- 2.21 Vlnové délky (λ) maximální absorpce ve vodě
- 2.22 Polymerizace
- 2.23 Reaktivita
- 2.24 Aldolová kondenzace
- 3 Syntéza
- 4 použití
- 4.1 Průmyslové
- 4.2 Ostatní
- 5 Rizika
- 6 Reference
Butanální struktura
Právě bylo zmíněno, že formylová skupina, -CHO, propůjčuje molekule butanalu nebo butyraldehydu polaritu kvůli vyšší elektronegativitě atomu kyslíku. V důsledku toho mohou jeho molekuly vzájemně interagovat prostřednictvím dipól-dipólových sil..
Na horním obrázku je s modelem koulí a pruhů ukázáno, že butanální molekula má lineární strukturu. Uhlík skupiny -CHO má sp hybridizacidva, zatímco zbývající uhlíky sp hybridizují3.
Nejen to, ale je také flexibilní a jeho články se mohou otáčet na svých vlastních osách; a tak se generují různé konformace nebo konformery (stejná sloučenina, ale s rotujícími odkazy).
Konformátoři
Následující obrázek lépe vysvětluje tento bod:
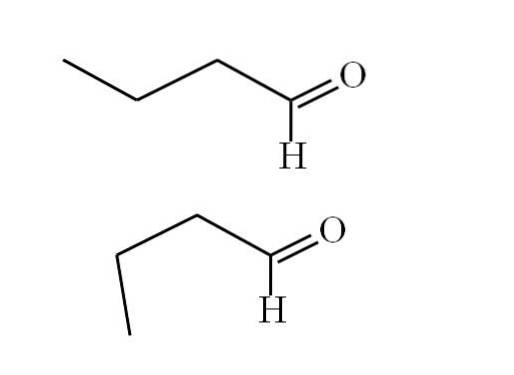
První konformor (horní) odpovídá molekule na prvním obrázku: methylová skupina vlevo, -CH3, a skupina -CHO, jsou v polohách navzájem protilehlých; jeden ukazuje nahoru a druhý dolů.
Mezitím druhý konformer (spodní) odpovídá molekule s -CH3 a -CHO v zatměných polohách; to znamená, že oba ukazují stejným směrem.
Oba konformery jsou rychle zaměnitelné, a proto se butanální molekula neustále otáčí a vibruje; a navíc skutečnost, že má permanentní dipól, to umožňuje jeho interakcím dostatečně silné, aby se vařily při 74,8 ° C..
Vlastnosti
Chemické názvy
-Butanal
-Butyraldehyd
-1-Butanal
-Butyral
-N-butyraldehyd.
Molekulární vzorec
C4H8O nebo CH3CHdvaCHdvaCHO.
Fyzický vzhled
Je to čirá, průhledná kapalina.
Zápach
Charakteristický, štiplavý, aldehydový zápach.
Bod varu
167 ° F až 760 mmHg (74,8 ° C).
Bod tání
-146 ° F (-96,86 ° C).
bod vznícení
-8 ° F (-22 ° C) uzavřený kelímek.
Rozpustnost ve vodě
7 g / 100 ml při 25 ° C.
Rozpustnost v organických rozpouštědlech
Mísitelný s ethanolem, etherem, ethylacetátem, acetonem, toluenem a mnoha dalšími organickými rozpouštědly.
Hustota
0,803 g / cm3 při 68 ° F.
Hustota par
2,5 (ve vztahu k nasávanému vzduchu rovné 1).
Tlak páry
111 mmHg při 25 ° C.
Automatické zapalování
446 ° F. 425 ° F (21,8 ° C).
Viskozita
0,45 cPoise při 20 ° C.
Spalné teplo
2479,34 kJ / mol při 25 ° C.
Odpařovací teplo
33,68 kJ / mol při 25 ° C.
Povrchové napětí
29,9 dynu / cm při 24 ° C.
Prahová hodnota zápachu
0,009 ppm.
Index lomu
1,3843 při 20 ° C.
Dipólový moment
2,72 D..
Vlnové délky (λ) maximální absorpce ve vodě
225 nm a 282 nm (ultrafialové světlo).
Polymerizace
Butanal může polymerovat při kontaktu s alkáliemi nebo kyselinami, přičemž polymerace je nebezpečná.
Reaktivita
Při vystavení vzduchu oxiduje a tvoří kyselinu máselnou. Při teplotě 230 ° C se butanal spontánně vznítí vzduchem.
Aldolová kondenzace
Dvě molekuly butanalu mohou vzájemně reagovat za přítomnosti KOH a teploty 6-8 ° C za vzniku sloučeniny 2-ethyl-3-hydroxyhexanolu. Tento typ sloučeniny se nazývá aldol, protože má ve své struktuře aldehydovou skupinu a alkoholovou skupinu.
Syntéza
Butanal lze vyrobit katalytickou dehydrogenací n-butylalkoholu; katalytická hydrogenace krotonaldehydu; a hydroformylace propylenu.
Aplikace
Průmyslový
-Butanal je průmyslové rozpouštědlo, ale je také meziproduktem při syntéze jiných rozpouštědel; například 2-ethylhexanol, n-butanol a trimethylpropan.
-Používá se také jako meziprodukt při výrobě syntetických pryskyřic, včetně polyvinylbutyralu; urychlovače vulkanizace gumy; výroba farmaceutických výrobků; přípravky na ochranu rostlin; pesticidy; antioxidanty; opalovací pomůcky.
-Butanal se používá jako surovina pro výrobu syntetických aromat. Kromě toho se používá jako látka určená k aromatizaci potravin.
Ostatní
-U člověka se butanal používá jako biomarker indikující oxidační poškození lipidů, proteinů a nukleových kyselin.
-Byl použit experimentálně spolu s formalinem a glutardehydem, aby se pokusilo snížit změkčení, které zažívají kopyta skotu, v důsledku vystavení vodě, moči a výkalům samotného skotu. Výsledky experimentu byly pozitivní.
Rizika
Butanal je destruktivní pro sliznice horních dýchacích cest, stejně jako pro tkáně kůže a očí..
Při kontaktu s pokožkou způsobuje zarudnutí a popáleniny. V očích dochází ke stejným zraněním, doprovázeným bolestí a poškozením oční tkáně.
Vdechování butanalu může mít vážné následky, protože může způsobit zánět a otoky v hrtanu a průduškách; zatímco v plicích produkuje chemický zápal plic a plicní edém.
Mezi příznaky nadměrné expozice patří: pocity pálení v horních dýchacích cestách, kašel, sípání, tj. Sípání při dýchání; laryngitida, dušnost, bolesti hlavy, nevolnost a také zvracení.
Vdechnutí může být smrtelné v důsledku křečí dýchacích cest.
Požití butanalu způsobuje pocit „pálení“ v zažívacím traktu: ústní dutině, hltanu, jícnu a žaludku.
Reference
- Morrison, R. T. a Boyd, R. N. (1987). Organická chemie. (5ta Edice.). Redakční Addison-Wesley Iberoamericana.
- Carey F. (2008). Organická chemie. (Šesté vydání). Mc Graw Hill.
- PubChem. (2019). Butanal. Obnoveno z: pubchem.ncbi.nim.nih.guv
- Wikipedia. (2019). Butanal. Obnoveno z: es.wikipedia.org
- Chemická kniha. (2017). Butanal. Obnoveno z: chemicalbook.com
- Basf. (Květen 2017). N-butyraldehyd. [PDF]. Obnoveno z: solvents.basf.com



Zatím žádné komentáře