
Struktura kalmodulinu, funkce a mechanismus účinku
Kalmodulin "Termín, který znamená" protein modulovaný vápníkem ", a označuje malý intracelulární protein, který má schopnost vázat se na iont vápníku (Ca ++) a zprostředkovat mnoho z jeho intracelulárních účinků. Původ slova pochází z kombinace anglických slov „vápník“, „modulovaný“ a „protein“, které, když se dají dohromady, vzniknou v LIMETKAcium MODULated proteV.
Mezi minerálními prvky, které se stávají součástí živočišných organismů, je zdaleka nejhojnější vápník, následovaný fosforem, protože kost je tvořena ukládáním velkého množství minerálních solí vytvořených z tohoto iontu v matrici.

Tyto minerální soli vápníku jsou samozřejmě nezbytné pro konstituci a konformaci kosterního systému obratlovců, ale je to ionizovaná forma vápníku (Ca ++) v roztoku v tělních tekutinách, která získává relevantní fyziologický význam pro život člověka. zvířata.
Tento kation se dvěma přebytečnými kladnými elektrickými náboji ve své struktuře může působit jako nosič proudu pohybem přes buněčnou membránu a úpravou úrovně elektrického potenciálu v mnoha excitabilních buňkách těla, zejména v srdečním svalu.
Ale větší fyziologický význam má skutečnost, že mnoho buněčných regulačních reakcí vyvolaných vnějšími podněty, jako jsou neurotransmitery, hormony nebo jiné fyzikální nebo biochemické faktory, jsou druhy metabolických kaskád, na kterých se postupně podílí několik proteinů, z nichž některé jsou enzymy, které vyžadují vápník pro aktivaci nebo inaktivaci.
V těchto případech se říká, že vápník působí jako druhý posel v metabolické kaskádě, jehož cílem je dosáhnout konečného výsledku, který by byl jako buněčná odpověď nezbytná k uspokojení potřeby zjištěné na jiné úrovni odlišné od samotné buňky, a že to od ní vyžaduje tuto konkrétní odpověď.
Vápník může působit přímo na svůj biochemický cíl, aby ovlivnil jeho aktivitu, ale často vyžaduje účast proteinu, se kterým se musí vázat, aby mohl ovlivnit modifikovaný protein (proteiny). Kalmodulin je jedním z těchto mediátorových proteinů.
Rejstřík článků
- 1 Struktura
- 2 Funkce kalmodulinu
- 3 Mechanismus účinku
- 3.1 Kalmodulin a kontrakce hladkého svalstva
- 3.2 Adaptace v čichových senzorech
- 4 Kalmodulin v rostlinách
- 5 Reference
Struktura
Kalmodulin, vysoce všudypřítomný, protože je exprimován téměř ve všech buněčných typech eukaryotických organismů, je malý kyselý protein s molekulovou hmotností přibližně 17 kDa, jehož struktura je mezi druhy vysoce konzervativní..
Jedná se o monomerní protein, to znamená, že je tvořen jediným polypeptidovým řetězcem, který na svých koncových koncích má formu globulárních domén spojených alfa šroubovicí. Každá kulová doména má dva motivy známé jako EF ruka. EF ruka), které jsou typické pro proteiny vázající vápník.
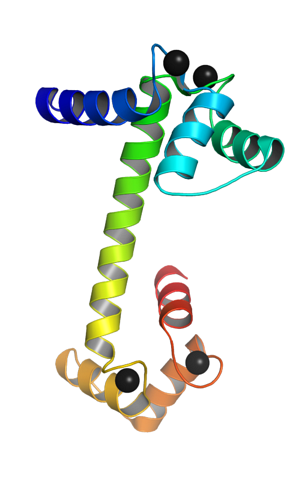
Tyto topologické motivy „EF hand“ představují jakýsi druh supersekundárních struktur; jsou navzájem spojeny v každé globulární doméně oblastí s velkou flexibilitou a v každé z nich je vazebné místo pro Ca ++, které poskytuje celkem 4 místa pro každou molekulu kalmodulinu.
Vazba kladně nabitých iontů vápníku je umožněna přítomností aminokyselinových zbytků se záporně nabitými postranními řetězci v místech vápníku vázajících kalmodulin. Těmito zbytky jsou tři aspartáty a jeden glutamát..
Funkce kalmodulinu
Všechny dosud známé funkce kalmodulinu jsou součástí skupiny akcí podporovaných zvýšením cytosolického vápníku produkovaného jeho vstupem z extracelulárního prostoru nebo jeho výstupem z intracelulárních depozit: mitochondrie a endoplazmatické retikulum.
Mnoho iontů vápníku se provádí tímto iontem přímým působením na jeho cílové proteiny, které mohou mít různé typy a funkce. Některé z těchto proteinů nelze přímo ovlivnit, ale vyžadují vazbu vápníku na kalmodulin a právě tento komplex působí na protein ovlivněný iontem..
Říká se, že tyto cílové proteiny jsou závislé na kalcium-kalmodulinu a zahrnují desítky enzymů, jako jsou proteinové kinázy, proteinové fosfatázy, nukleotidové cyklasy a fosfodiesterázy; všichni zapojeni do nesčetných fyziologických funkcí včetně:
- Metabolismus
- Přeprava částic
- Viscerální mobilita
- Sekrece látek
- Oplodnění vajíček
- Genový výraz
- Proliferace buněk
- Strukturální integrita buněk
- Mezibuněčná komunikace atd.
Mezi proteiny kinázy závislé na kalmodulinu patří: kináza myosinového lehkého řetězce (MLCK), kináza fosforylázy a Ca ++ / kalmodulin kinázy I, II a III.
Informace kódovaná signály vápníku (zvýšení nebo snížení jeho intracelulární koncentrace) je tedy „dekódována“ tímto a dalšími proteiny vázajícími vápník, které převádějí signály na biochemické změny; Jinými slovy, kalmodulin je meziproduktem bílkoviny v signálních procesech závislých na vápníku.
Mechanismus účinku
Kalmodulin je velmi všestranný protein, protože jeho „cílové“ proteiny se značně liší tvarem, sekvencí, velikostí a funkcí. Jelikož se jedná o protein, který funguje jako „senzor“ pro ionty vápníku, jeho mechanismus účinku závisí na změnách vyvolaných v jeho struktuře a / nebo konformaci, jakmile se váže na čtyři z těchto iontů..
Jeho mechanismy působení lze ilustrovat krátkým přehledem jeho účasti na několika fyziologických procesech, jako je kontrakce hladkého svalstva vnitřních orgánů a adaptace na pachy, kterým trpí vlasové buňky čichové sliznice v nose..
Kalmodulin a kontrakce hladkého svalstva
Kontrakce kosterního a srdečního svalu se spustí, když zvýšení cytosolického Ca ++ dosáhne úrovně nad 10–6 mol / l a tento iont se váže na troponin C, který podléhá alosterickým změnám, které ovlivňují tropomyosin. Na druhé straně se tropomyosin pohybuje a vystavuje svá místa vázající myosin v aktinu, což vede ke spuštění kontraktilního procesu.
Troponin C neexistuje v hladkém svalu a zvýšení Ca ++ nad uvedenou hladinu podporuje jeho vazbu s kalmodulinem. Komplex Ca-kalmodulin aktivuje kinázu lehkého řetězce myosinu (MLCK), která zase fosforyluje tento lehký řetězec, aktivuje myosin a spouští kontraktilní proces..
Ke zvýšení Ca ++ dochází jeho vstupem zvenčí nebo jeho výstupem ze sarkoplazmatického retikula působením inositol trifosfátu (IP3) uvolněného fosfolipázou C v kaskádě aktivované receptory navázanými na Gq protein. K uvolnění dochází, když je Ca ++ působením transportérů odstraněn z cytosolu a vrátí se na místa původu.
Důležitým rozdílem mezi oběma typy kontrakcí je to, že ve pruhovaných svalech (srdečních a kosterních) Ca ++ indukuje alosterické změny vazbou na svůj protein, troponin, zatímco v hladkých svalech jsou změny produkované Ca-kalmodulinem kovalentní a zahrnují fosforylaci myosinu.
Jakmile tedy působení Ca ++ skončí, je k odstranění fosfátu přidaného kinázou nutná účast jiného enzymu. Tímto novým enzymem je fosfatáza lehkého řetězce myosinu (MLCP), jejíž aktivita nezávisí na kalmodulinu, ale je regulována jinými cestami.
Ve skutečnosti kontraktilní proces hladkého svalstva úplně neustává, ale stupeň kontrakce zůstává na střední úrovni v důsledku rovnováhy účinků obou enzymů, MLCK řízeného Ca ++ a kalmodulinem, a MLCP podléhá dalším regulačním kontrolám.
Adaptace v čichových senzorech
Zápach je vyvolán aktivací čichových receptorů v řasinkách buněk na povrchu čichové sliznice..
Tyto receptory jsou spojeny s heterotrimerním G proteinem známým jako „Golf“ (čichový G protein), který má tři podjednotky: „αolf“, „ß“ a „γ“.
Když jsou čichové receptory aktivovány v reakci na zápach, podjednotky tohoto proteinu disociují a podjednotka „aolf“ aktivuje enzym adenylcyklázu za vzniku cyklického adenosinmonofosfátu (cAMP)..
CAMP aktivuje kanály podobné CNG (aktivované cyklickými nukleotidy) pro vápník a sodík. Tyto ionty vstupují do buňky, depolarizují ji a způsobují iniciaci akčních potenciálů, jejichž frekvence určuje intenzitu zápachu..
Vápník, který vstupuje a který má tendenci depolarizovat buňku, má antagonistický účinek negativní zpětné vazby, o něco později, tím, že se váže na kalmodulin a mezi nimi uzavírá kanál a eliminuje depolarizační stimul, i když pachový stimul přetrvává. Tomu se říká adaptace senzoru.
Kalmodulin v rostlinách
Rostliny také reagují na rozdíly v intracelulární koncentraci iontů vápníku prostřednictvím proteinu kalmodulinu. V těchto organismech mají kalmoduliny mnoho strukturálních a funkčních charakteristik se svými protějšky u zvířat a kvasinek, i když se v některých funkčních aspektech liší..
Například kalmodulin v rostlinách se váže na krátké peptidové sekvence v jejich cílových proteinech a vyvolává strukturální změny, které mění jejich aktivity v reakci na vnitřní variace vápníku..
Do jaké míry dnes zůstává předmětem diskuse kalmodulinové kontrolní procesy analogické těm, které se vyskytují u zvířat v rostlinách..
Reference
- Brenner B: Musculatur, v: Fyziologie, 6. vydání; R. Klinke a kol. (Eds). Stuttgart, Georg Thieme Verlag, 2010.
- Ganong WF: Celulární a molekulární základy lékařské fyziologie, in: Recenze lékařské fyziologie, 25. vydání New York, McGraw-Hill Education, 2016.
- Guyton AC, Hall JE: Úvod do endokrinologie, in: Učebnice lékařské fyziologie, 13. vydání, AC Guyton, JE Hall (eds). Philadelphia, Elsevier Inc., 2016.
- Kaup UB, Müller F: Olfactorisches System, In: Physiologie, 4. vydání; P Deetjen a kol. (Eds). München, Elsevier GmbH, Urban & Fischer, 2005.
- Korbmacher C, Greger R, Brenner B, Silbernagl S: Die Zelle als Grundbaustein, in: Fyziologie, 6. vydání; R. Klinke a kol. (Eds). Stuttgart, Georg Thieme Verlag, 2010.
- Zielinski, R. E. (1998). Kalmodulin a proteiny vázající kalmodulin v rostlinách. Roční přehled biologie rostlin, 49 (1), 697-725.


Zatím žádné komentáře