
Latentní teplo

Co je to latentní teplo?
Latentní teplo je množství tepla, které látka potřebuje absorbovat nebo uvolnit, aby změnila svůj fyzický stav nebo fázi, přičemž během tohoto procesu udržuje konstantní teplotu. Dodané nebo uvolněné teplo se neprojevuje, „necítí“, jak je obvyklé při teplotních výkyvech; odtud termín latentní teplo.
Latentní slovo pochází z latinského slova „latens“, což znamená skryté, takže latentní teplo se chová, jako by neexistovalo, když byla teplota udržována konstantní. Ale existuje: to, co se stane, je, že je zcela spotřebováno ve fázové změně nebo fyzickém stavu.
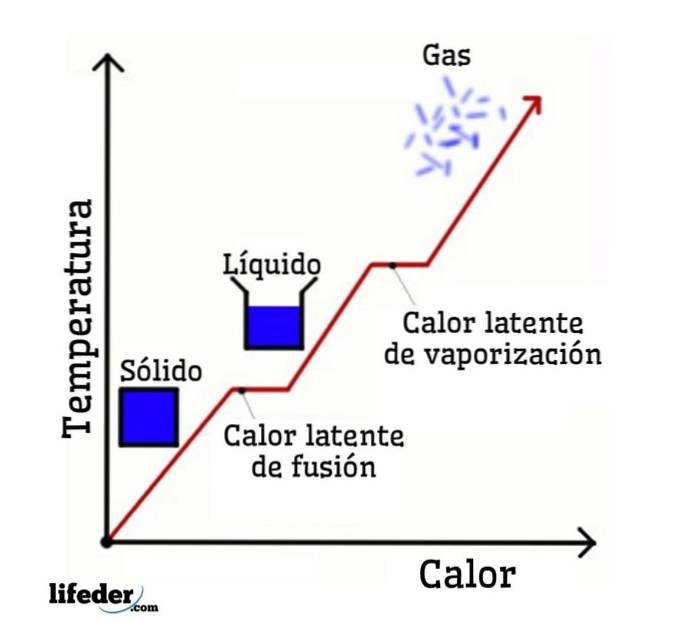
Vezmeme-li vodu jako příklad, fázové změny jsou následující: led (pevná látka) se taví na kapalnou vodu (kapalinu) v procesu zvaném tavení; a kapalná voda se zase odpařuje a transformuje se na vodní páru (plyn) v procesu zvaném vaporizace.
Na druhou stranu je vodní pára ochlazována na kapalnou vodu v procesu zvaném kondenzace; a kapalná voda se mění zpět na led v procesu zvaném tuhnutí.
Každá z těchto fázových změn je spojena s latentním teplem, které může být pozitivní (absorpce) nebo negativní (uvolnění)..
Latentní teplo fúze

Je to množství tepla, které musí být dodáno danému množství pevné látky, aby se změnil její fyzický stav z pevného na kapalný. Během fúze nedochází ke změně teploty, takže zatímco se pevná látka roztaví nebo roztaví kapalina, která je z ní generována, má stejnou teplotu jako celá pevná látka.
Obecně se toto teplo určuje při normální teplotě tání, což je teplota, při které se pevná látka začíná tát za atmosférického tlaku. Při této teplotě je rovnováha nebo současná přítomnost pevného a kapalného stavu současně..
Pevný stav je charakterizován přítomností kompaktní struktury v důsledku existence vysokoenergetických chemických vazeb, které jí dodávají strukturní tuhost. Pro transformaci pevné látky na kapalinu musí být tyto interakce přerušeny, takže energie je za tímto účelem spotřebována (absorbována).
Typickým příkladem je, když je zmrzlina konzumována z vody, cukru a dalších látek. Je běžné pozorovat, že zmrzlina, pokud není rychle spotřebována, se začne tavit, to znamená, že se bude tavit. K tomu dochází, když teplota zmrzliny dosáhne bodu tání ledu..
Příklady
Budou uvedeny některé příklady latentních tepla fúze vyjádřených v J / g; tj. energie, kterou musí absorbovat gram pevné látky, aby se roztavila v bodě tání:
-Led 334.0
-Hliník 380.0
-Síra 38.1
-Měď 134,0
-Ethanol 104,0
-Rtuť 11.8
-Zlato 64,5
-Stříbro 80.3
-Vedení 24.5
-Tungsten 184
Led absorbuje hodně tepla ne proto, že by jeho interakce byly silnější, ale proto, že je schopen výjimečně odvádět teplo mezi svými krystaly..
Latentní výparné teplo
Je to množství tepla, které dané množství látky absorbuje, aby se změnilo z kapalného stavu na plynné za normálního bodu varu. To znamená, že je to teplo, které kapalina absorbuje, když se vaří a přemění se na plyn bez zvýšení teploty..
V kapalině mohou molekuly látek interagovat tvorbou vodíkových vazeb a přitahovacími silami mezi molekulami. K průchodu látky z kapalného stavu do plynného musí být tyto síly překonány, takže musí být dodáno teplo.
Citelné teplo je to, co kapalina absorbuje, pouze aby zvýšila svoji teplotu, která bude záviset na jejím specifickém teple. Mezitím se latentní teplo odpařování používá k jeho transformaci přímo na páru, což je proces, který je v bodě varu mnohem jednodušší..
Příklady
Níže jsou uvedeny příklady některých kapalin s příslušnými latentními odpařovacími teplotami, které jsou opět vyjádřeny v J / g:
-Kyselina octová 402
-Aceton 518
-Voda 2256
-Ethylalkohol 846
-Síra 1510
-Benzen 390
-Oxid uhličitý 574
-Chlor 293
-Ether 377
-Glycerin 974
-Merkur 295
-Kyslík 214
Všimněte si enormního latentního tepla kapalné vody: 1 g kapalné vody (asi 1 ml) musí absorbovat 2256 J, aby se odpařilo. Kapalná voda rozptyluje přijímané teplo ještě lépe ve srovnání s ledem.
Latentní teplo tuhnutí
Je to teplo, které musí určité množství látky vydávat, aby přešlo z kapalného stavu do pevného stavu v místě tuhnutí nebo zmrazení. Opět platí, že dokud kapalina zcela neztuhne, teplota zůstane konstantní..
Proces tuhnutí je opakem procesu fúze, takže hodnoty latentního tepla tuhnutí a hodnoty latentního tepla fúze jsou stejné, ale s opačnými znaménky..
Molekuly látky v kapalném stavu se díky energii, kterou mají, pohybují s určitou svobodou. Aby tedy molekuly mohly přejít do pevné fáze, musí uvolňovat energii ve formě tepla, což umožňuje větší interakci mezi molekulami látky..
Interakce mezi molekulami podporuje tvorbu chemických vazeb pevné fáze. Příkladem toho je situace, kdy je do nádob na tvorbu ledu v ledničce umístěna kapalná voda. Mraznička extrahuje teplo z kapalné vody a tuhne a stává se ledem.
Příklady
Některé příklady latentních teplot tuhnutí (v J / g) pro některé kapaliny jsou uvedeny níže:
-Voda (-334)
-Hliník (-380)
-Síra (-38)
-Měď (-134)
-Ethanol (-104)
Latentní teplo kondenzace
Je to množství tepla, které musí být vydáno nebo uvolněno z určitého množství látky, aby bylo možné přejít z plynného stavu do kapalného. Plyn, který kondenzuje, a vytvořená kapalina udržují během kondenzace stejnou teplotu.
Kondenzace je opakem odpařování. Latentní kondenzační teplo má stejnou hodnotu jako latentní teplo odpařování, ale s opačným znaménkem a při teplotě varu. Příkladem toho je vaření a kondenzace páry na vnitřní straně hrnců..
Plynné molekuly se volně pohybují poháněné energií, kterou mají. Proto musí uvolňovat energii, aby umožnily mezimolekulární interakce kapalného stavu mezi molekulami látky..
V přírodě existuje mnoho dalších příkladů fenoménu kondenzace vody. Vodní pára stoupá v atmosféře a kondenzuje v oblacích ve formě vodních kapiček.
Rovněž je pozorována přítomnost kapiček vody ve sklech automobilů v důsledku kondenzace vody v důsledku poklesu teploty, ke kterému dochází brzy ráno, což představuje tzv. Rosu.
Příklady
Nakonec u některých par budou uvedeny jejich příslušné latentní kondenzace vyjádřené opět v J / g:
-Kyselina octová (-402)
-Aceton (-518)
-Voda (-2256)
-Ethylalkohol (-846)
-Síra (-1510)
-Benzen (-390)
Reference
- Whitten, Davis, Peck a Stanley. (2008). Chemie. (8. vydání). Učení CENGAGE.
- Walter J. Moore. (1963). Fyzikální chemie. V chemické kinetice. Čtvrté vydání, Longmans.
- Wikipedia. (2020). Latentní teplo. Obnoveno z: en.wikipedia.org
- Redaktoři Encyclopaedia Britannica. (2020). Latentní teplo. Obnoveno z: britannica.com
- Engineering ToolBox. (2003). Kapaliny: Latentní teplo odpařování. Obnoveno z: engineeringtoolbox.com
- Lumen učení. (s.f.). Fázová změna a latentní teplo. Obnoveno z: courses.lumenlearning.com



Zatím žádné komentáře