
Charakteristika kyselin a zásad

Charakteristiky kyselin a zásad jsou všechny ty vlastnosti a vlastnosti, s nimiž můžeme rozlišovat mezi kyselinou a zásadou..
Podle Arrehniusovy teorie, a kyselina je látka, která uvolňuje protony H+ po rozpuštění ve vodě a a základna je jakákoli látka, která uvolňuje hydroxylové ionty OH- ve vodném roztoku.
| Kyseliny | Základny | |
|---|---|---|
| Tvorba iontů | Současnost, dárek | Současnost, dárek |
| Neutralizační reakce | Když reagujete základnou. | Když reaguje s kyselinou. |
| Rozpustnost ve vodě | Rozpustný | Částečně rozpustný. Hydroxidy vápníku, barya a hliníku jsou špatně rozpustné. |
| Elektrická vodivost | Současnost, dárek | Současnost, dárek |
| Stav hmoty | Pevné, kapalné nebo plynné | Pevné, kapalné nebo plynné |
| Reakce s lakmusovým papírkem | Červené zbarvení | Modré zbarvení |
| hodnota PH | Pod 7 let | Větší než 7 |
| Konjugovaný protějšek | Slabá kyselina tvoří konjugovanou bázi. | Slabá báze tvoří konjugovanou kyselinu. |
| Žíravý účinek | Silné kyseliny | Silné základy |
Vlastnosti kyselin
Kyseliny mají několik charakteristik, se kterými je lze identifikovat.
Schopnost tvořit ionty z kyselin
Hlavní charakteristikou kyselých látek je, že mohou být ionizovány, to znamená, že mohou ztratit nebo získat elektrony.
Kyselina chlorovodíková HCl, silná kyselina, ionizuje za vzniku chloridového aniontu Cl- a proton H+.
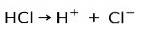
Neutralizační reakce
Kyselina reaguje s bází za vzniku soli a vody. Tato reakce je známá jako neutralizační reakce. Například HCl reaguje s NaOH za vzniku chloridu sodného NaCl (kuchyňská sůl) a vody:
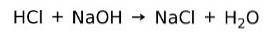
Rozpustnost kyselin ve vodě
Kyseliny jsou obecně rozpustné ve vodě. Například kyselina chlorovodíková nebo kyselina muriatic je středně rozpustná ve vodě, až 82 g HCl lze rozpustit ve 100 ml vody při 0 ° C. V případě kyseliny sírové HdvaSW4, míchání s vodou vytváří teplo, proto je vždy vhodné přidat do vody kyselinu, aby nedošlo k výbuchu.
Kyselinová síla
To, jak kyseliny disociují, určuje, zda jsou silné nebo slabé. Síla kyseliny je dána jejím disociační konstanta.
Kyselina dusičná HNO3 to je silná kyselina protože ve vodném roztoku zcela ionizuje na protony a dusičnanové ionty:
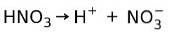
To znamená, že když přidáme HNO3 ve vodě, při analýze vody najdeme pouze H+ a dusičnanové ionty a prakticky žádný HNO3.
Místo toho je v octě kyselina octová slabá kyselina, protože pouze jeho část je disociována:
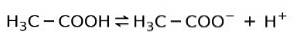
Proto je znázorněn šipkami ve dvou směrech, což znamená, že ve vodném roztoku budeme mít kyselinu octovou, H+ a acetátový anion (H3C-COO-).
Stavy látek kyselin
Kyseliny lze nalézt v kapalném, pevném nebo plynném stavu. Například kyselina chlorovodíková HCl je kapalná, sirovodík HS je plyn a kyselina šťavelová je pevná látka..
Reakce s lakmusovým papírkem z kyselin

Když vložíme proužek lakmusového papíru do kyselé látky, lakmusový papír zčervená.
Identifikace kyselin podle jejich pH
PH je míra množství H+ přítomný v řešení. Mezi pH 0 a 7 jsme tedy v přítomnosti kyseliny. Například ocet má pH rovné 2, pH kyseliny sírové v autobateriích je rovné 1.
Elektrická vodivost kyselin
Protože kyseliny mohou disociovat a produkovat elektricky nabité ionty, kyselé roztoky mohou vést elektřinu. Například uvnitř autobaterií se používá kyselina sírová, což je silná kyselina jako vodič elektřiny..
Leptavý účinek silných kyselin
Silné kyseliny působí korozivně, mohou spalovat organické tkáně, takže při manipulaci s nimi musí být velmi opatrné.
Slabé kyseliny tvoří konjugovaný protějšek
Slabé kyseliny po rozpuštění tvoří to, co je známé jako pár konjugátu, to znamená, že slabá kyselina tvoří konjugovanou bázi.
Například:
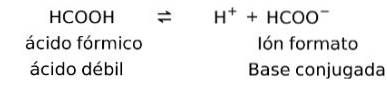
V tomto případě tvoří kyselina mravenčí nebo methanová (HCOOH), je-li disociována, konjugovaný formát iontové báze.
Mohlo by vás zajímat:
- Silné a slabé kyseliny a zásady.
- Příklady kyselin a zásad.
Charakteristika základen
Dále uvádíme vlastnosti bází nebo alkalických roztoků, které je charakterizují.
Základní ionizační kapacita
Základní nebo alkalické látky se vyznačují tvorbou iontů po rozpuštění ve vodě:
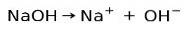
V tomto případě se hydroxid sodný NaOH ionizuje za vzniku hydroxidového aniontu OH- a kation sodný na Na+.
Báze reaguje s kyselinou za vzniku soli
Báze reaguje s kyselinou v neutralizační reakci za vzniku vody a soli, například:
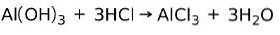
V tomto případě hydroxid hlinitý Al (OH)3, báze, reaguje s HCl a tvoří chlorid hlinitý sůl AlCl3 a voda. Hydroxid hlinitý se používá jako antacida ke zmírnění žaludečního refluxu neutralizací kyseliny produkované žaludkem.
Rozpustnost ve vodě
Některé zásady jsou rozpustné ve vodě. Hydroxidy alkalických zemin, jako je hydroxid vápenatý a hydroxid barnatý, jsou ve vodě špatně rozpustné. Například hydroxid sodný nebo hydroxid sodný lze rozpustit 109 g ve 100 ml vody při 20 ° C. Zatímco hydroxid hořečnatý nebo hořčíkové mléko Mg (OH)dva je prakticky nerozpustný ve vodě.
Základní síla
V závislosti na stupni ionizace báze mohou být silné nebo slabé. Například hydroxid lithný je a silná základna protože ve vodném roztoku zcela ionizuje na hydroxidové ionty OH a lithium Li kationty+:
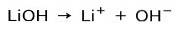
Na druhé straně amoniak NH3 je slabá základna protože při kontaktu s vodou ne všechny amoniak disociuje:
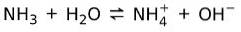
Základní stav hmoty
Báze lze nalézt v pevném, kapalném a plynném skupenství. Například čistý hydroxid sodný je pevný, amoniak je plyn.
Reakce s lakmusovým papírkem základen
Když vložíme proužek lakmusového papíru do alkalické látky, papír se zbarví modře.
Identifikace bází podle jejich pH
Báze se vyznačují tím, že mají pH mezi 7 a 14.
 Elektrická vodivost základen
Elektrická vodivost základen
Báze jsou díky své ionizační kapacitě dobrými vodiči elektřiny. Například v alkalických bateriích se jako elektrický vodič používá hydroxid draselný KOH..
Korozivní účinek bází
Silné zásady mohou poškodit organické tkáně. Například čisticí prostředky na kuchyňské trouby jsou obecně silným základem a vždy se s nimi doporučuje zacházet s maximální opatrností, používat rukavice a chránit oči..
Slabé báze tvoří konjugovaný protějšek
Slabé báze po rozpuštění tvoří konjugovaný protějšek, to znamená, že slabá báze tvoří konjugovanou kyselinu.
Například tris- (hydroxymethyl) aminomethan (OHCHdva)3CNHdva je slabá báze, jejíž konjugovaná kyselina je (OHCHdva)3CNH3+:
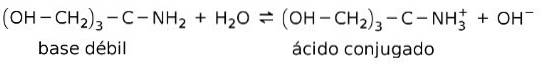
To je základem působení pufrovacích látek nebo nárazník, což jsou látky, které se používají k neustálému udržování pH roztoků.
Mohlo by vás zajímat, jaké jsou rozdíly mezi kyselinami a zásadami.



Zatím žádné komentáře