
Charakteristiky primárního uhlíku, typy a příklady
The primární uhlík Jde o to, že v jakékoli sloučenině, bez ohledu na její molekulární prostředí, vytváří vazbu s alespoň jedním dalším atomem uhlíku. Tato vazba může být jednoduchá, dvojitá (=) nebo trojitá (≡), pokud jsou spojeny pouze dva atomy uhlíku a v sousedních polohách (logicky).
Vodíky přítomné na tomto uhlíku se nazývají primární vodíky. Chemické vlastnosti primárního, sekundárního a terciárního vodíku se však liší jen málo a jsou převážně předmětem molekulárního prostředí uhlíku. Z tohoto důvodu je primární uhlík (1 °) obvykle zpracován s větší důležitostí než jeho vodíky.
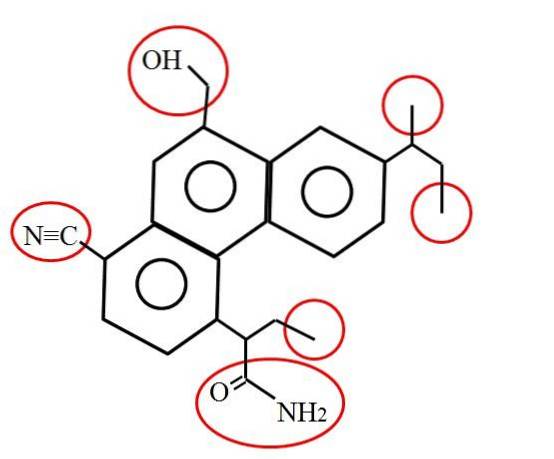
A jak vypadá primární uhlík? Odpověď závisí, jak již bylo uvedeno, na vašem molekulárním nebo chemickém prostředí. Například výše uvedený obrázek označuje primární uhlíky uzavřené v červených kruzích ve struktuře hypotetické (i když pravděpodobně skutečné) molekuly..
Pokud se podíváte pozorně, zjistíte, že tři z nich jsou identické; zatímco ostatní tři jsou úplně jiní. První tři se skládají z methylových skupin, -CH3 (napravo od molekuly) a ostatní jsou methylolové skupiny, -CHdvaOH, nitril, -CN a amid, RCONHdva (nalevo od molekuly a pod ní).
Rejstřík článků
- 1 Vlastnosti primárního uhlíku
- 1.1 Umístění a odkazy
- 1.2 Nízká sterická překážka
- 1.3 Reaktivita
- 2 druhy
- 3 příklady
- 3.1 Aldehydy a karboxylové kyseliny
- 3.2 V lineárních aminech
- 3.3 V alkylhalogenidech
- 4 Odkazy
Vlastnosti primárního uhlíku
Umístění a odkazy
Nahoře bylo zobrazeno šest primárních uhlíků, kromě jejich umístění a toho, jaké další atomy nebo skupiny je doprovázejí, není žádný komentář. Mohou být kdekoli ve struktuře a kdekoli jsou, označují „konec silnice“; tj. kde část kostry končí. Proto se někdy označují jako koncové uhlíky..
Je tedy zřejmé, že skupiny -CH3 jsou koncové a jejich uhlík je 1 °. Všimněte si, že tento uhlík se váže na tři vodíky (které byly na obrázku vynechány) a na jeden uhlík a doplňuje jejich příslušné čtyři vazby..
Proto jsou všechny charakterizovány tím, že mají vazbu C-C, vazbu, která může být také dvojná (C = CHdva) nebo trojnásobek (C≡CH). To zůstává pravda, i když jsou k těmto uhlíkům připojeny další atomy nebo skupiny; jako u ostatních tří zbývajících 1 ° uhlíků na obrázku.
Nízká sterická překážka
Bylo zmíněno, že primární uhlíky jsou koncové. Tím, že signalizují konec úseku kostry, s nimi prostorově nezasahují žádné další atomy. Například skupiny -CH3 mohou interagovat s atomy jiných molekul; ale jejich interakce se sousedními atomy stejné molekuly jsou nízké. Totéž platí pro -CHdvaOH a -CN.
Je to proto, že jsou prakticky vystaveny „vakuu“. Proto obecně představují nízkou sterickou zábranu ve vztahu k ostatním typům uhlíku (2., 3. a 4.).
Existují však výjimky, produkt molekulární struktury s příliš mnoha substituenty, vysokou flexibilitou nebo tendencí uzavírat se do sebe..
Reaktivita
Jedním z důsledků spodní sterické zábrany kolem 1. uhlíku je větší expozice reakce s jinými molekulami. Čím méně atomů bude bránit cestě útočící molekuly k ní, tím pravděpodobnější bude její reakce..
To však platí pouze ze sterického hlediska. Ve skutečnosti je nejdůležitějším faktorem ten elektronický; to znamená, jaké je prostředí uvedených uhlíků 1 °.
Uhlík sousedící s primární, přenáší na něj část své elektronické hustoty; a totéž se může stát v opačném směru, což zvýhodňuje určitý typ chemické reakce.
Sterické a elektronické faktory tedy vysvětlují, proč je obvykle nejreaktivnější; ačkoli pro všechny primární uhlíky skutečně neexistuje globální pravidlo reaktivity.
Typy
Primární uhlíky postrádají vlastní klasifikaci. Místo toho jsou klasifikovány na základě skupin atomů, ke kterým patří nebo ke kterým jsou vázány; Toto jsou funkční skupiny. A protože každá funkční skupina definuje určitý typ organické sloučeniny, existují různé primární uhlíky.
Například skupina -CHdvaOH je odvozen od primárního alkoholu RCHdvaACH. Primární alkoholy proto sestávají z 1 ° uhlíků navázaných na hydroxylovou skupinu, -OH.
Na druhou stranu nitrilová skupina, -CN nebo -C = N, může být přímo připojena k atomu uhlíku pouze jednoduchou vazbou C-CN. Existence sekundárních nitrilů (R.dvaCN) nebo mnohem méně terciární (R.3CN).
Podobný případ nastává se substituentem odvozeným od amidu, -CONHdva. Může podstoupit substituce vodíků atomu dusíku; ale jeho uhlík se může vázat pouze na jiný uhlík, a proto bude vždy považován za primární, C-CONHdva.
A s ohledem na skupinu -CH3, Jedná se o alkylovou náhražku, která se může vázat pouze na jiný uhlík, a je tedy primární. Pokud se uvažuje o ethylové skupině, -CHdvaCH3, okamžitě si všimnete, že CHdva, methylenová skupina, je 2 ° uhlík, protože je vázán ke dvěma uhlíkům (C-CHdvaCH3).
Příklady
Aldehydy a karboxylové kyseliny
Byly zmíněny některé příklady primárních uhlíků. Kromě nich existuje následující pár skupin: -CHO a -COOH, nazývané formyl, respektive karboxyl. Uhlíky těchto dvou skupin jsou primární, protože vždy budou tvořit sloučeniny vzorce RCHO (aldehydy) a RCOOH (karboxylové kyseliny).
Tato dvojice spolu úzce souvisí díky oxidačním reakcím, které formalová skupina podléhá transformaci na karboxyl:
RCHO => RCOOH
Reakce aldehydů nebo skupiny -CHO, pokud je v molekule jako substituent.
V lineárních aminech
Klasifikace aminů závisí výlučně na stupni substituce vodíků skupiny -NHdva. U lineárních aminů však lze pozorovat primární uhlíky, jako u propanaminu:
CH3-CHdva-CHdva-NHdva
Všimněte si, že CH3 vždy to bude 1. uhlík, ale tentokrát CHdva na pravé straně je také 1 °, protože je navázán na jediný uhlík a NH skupinudva.
V alkylhalogenidech
Příklad velmi podobný předchozímu je uveden s alkylhalogenidy (a v mnoha dalších organických sloučeninách). Předpokládejme, že brompropan:
CH3-CHdva-CHdva-Br
V něm zůstávají primární uhlíky stejné.
Závěrem lze říci, že 1 ° uhlíky přesahují typ organické sloučeniny (a dokonce i organokovové), protože mohou být přítomny v jakékoli z nich a jsou identifikovány jednoduše proto, že jsou spojeny s jediným uhlíkem.
Reference
- Graham Solomons T.W., Craig B.Fryhle. (2011). Organická chemie. Miny. (10th edice.). Wiley plus.
- Carey F. (2008). Organická chemie. (Šesté vydání). Mc Graw Hill.
- Morrison, R. T. a Boyd, R. N. (1987). Organická chemie. (5ta Edice). Redakční Addison-Wesley Interamericana.
- Ashenhurst J. (16. června 2010). Primární, sekundární, terciární, kvartérní v organické chemii. Mistr v organické chemii. Obnoveno z: masterorganicchemistry.com
- Wikipedia. (2019). Primární uhlík. Obnoveno z: en.wikipedia.org

Zatím žádné komentáře