
Vlastnosti cykloalkanů, reakce, použití, příklady

The cykloalkany jsou rodinou nasycených uhlovodíků s obecným vzorcem CnH2n který se shoduje s tím alkenů; s tím rozdílem, že zdánlivá nenasycenost není způsobena dvojnou vazbou, ale kruhem nebo cyklem. Proto jsou považovány za izomery alkenů.
Ty vznikají, když se lineární alkany spojí s konci svých řetězců a vytvoří uzavřenou strukturu. Stejně jako u alkanů mohou cykloalkany vykazovat různé velikosti, molekulové hmotnosti, substituce nebo dokonce systémy složené z více než jednoho kruhu (polycyklické).
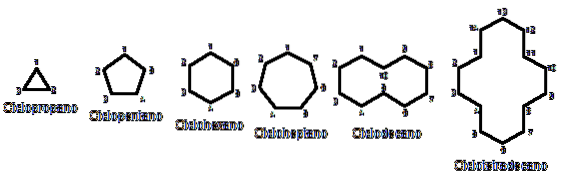
Jinak jsou chemicky a fyzicky podobné alkanům. Mají pouze uhlíky a vodíky, jsou neutrální molekuly, a proto interagují prostřednictvím Van der Wallsových sil. Slouží také jako paliva a uvolňují teplo, když hoří v přítomnosti kyslíku..
Proč jsou cykloalkany nestabilnější než jejich protějšky s otevřeným řetězcem? Důvod lze podezření pozorováním z ptačí perspektivy příklady cykloalkanů znázorněných na obrázku výše: existují sterická (prostorová) napětí a překážky.
Všimněte si, že čím méně uhlíků je (uvedeno modře), tím je struktura uzavřenější; a opak nastává, když se zvětšují a stávají se jako náhrdelník.
Malé cykloalkany jsou plynné a se zvětšováním jejich velikostí rostou i jejich mezimolekulární síly. V důsledku toho to mohou být kapaliny schopné rozpouštět tuky a nepolární molekuly, lubrikanty nebo pevné látky, které vykazují tmavé barvy a vlastnosti jako ty asfaltové..
Rejstřík článků
- 1 Fyzikální a chemické vlastnosti
- 1.1 Polarita
- 1.2 Intermolekulární interakce
- 1.3 Sytost
- 1.4 Stabilita
- 2 Názvosloví
- 3 Struktura
- 3.1 Konformace
- 4 Reakce
- 5 použití
- 6 Příklady cykloalkanů
- 7 Reference
Fyzikální a chemické vlastnosti
Polarita
Tím, že jsou složeny pouze z uhlíků a vodíků, atomů, které se samy o sobě příliš neliší v elektronegativitě, jsou molekuly cykloalkanu nepolární, a proto postrádají dipólový moment.
Nemohou interagovat prostřednictvím dipól-dipólových sil, ale závisí konkrétně na londýnských silách, které jsou slabé, ale rostou s molekulovou hmotností. Proto jsou malé cykloalkany (s méně než pěti uhlíky) plynné..
Intermolekulární interakce
Na druhou stranu, protože jsou to prsteny, mají cykloalkany větší kontaktní plochu, což upřednostňuje londýnské síly mezi jejich molekulami. Seskupují se a interagují tedy lepším způsobem ve srovnání s alkany; a proto jsou jeho teploty varu a tání vyšší.
Také proto, že mají o dva atomy vodíku méně (CnH2n pro cykloalkany a CnH2n + 2 pro alkany) jsou lehčí; a přidáním této skutečnosti k jeho větší kontaktní ploše se zmenšuje objem obsazený jeho molekulami, a proto jsou hustší.
Nasycení
Proč jsou cykloalkany klasifikovány jako nasycené uhlovodíky? Protože nemají způsob, jak začlenit molekulu vodíku; pokud se kruh neotevře, v takovém případě by se z nich staly jednoduché alkany. Aby byl uhlovodík považován za nasycený, musí mít maximální možný počet vazeb CH.
Stabilita
Chemicky jsou velmi podobné alkanům. Oba mají vazby C-C a C-H, které není tak snadné rozbít pro výrobu dalších produktů. Jejich relativní stability se však liší, což lze experimentálně ověřit měřením jejich spalovacích teplot (ΔHHřeben).
Například při porovnání ΔHHřeben pro propan a cyklopropan (na obrázku představovaný trojúhelníkem) máme 527,4 kcal / mol, respektive 498,9 kcal / mol.
Detaily spočívají v tom, že cyklopropan, založený na spalovacích teplotách alkanů, by měl mít ΔHHřeben nižší (471 kcal / mol), protože se jedná o tři methylenové skupiny, CHdva; ale ve skutečnosti uvolňuje více tepla, což odráží větší nestabilitu, než se odhaduje. Tato přebytečná energie se pak říká, že je způsobena napětími v kruhu..
Ve skutečnosti tato napětí řídí a odlišují reaktivitu nebo stabilitu cykloalkanů, s ohledem na alkany, proti specifickým reakcím. Pokud napětí není příliš vysoké, mají cykloalkany tendenci být stabilnější než jejich příslušné alkany..
Nomenklatura
Názvosloví IUPAC pro cykloalkany se příliš neliší od názvosloví pro alkany. Nejjednodušší pravidlo ze všech je umístit předponu cyklo- na název alkanu, ze kterého je cykloalkan vytvořen.
Tak například z n-hexanu, CH3CHdvaCHdvaCHdvaCHdvaCH3, dostanete cyklohexan (na prvním obrázku je to šestiúhelník). Totéž se děje s cyklopropanem, cyklobutanem atd..
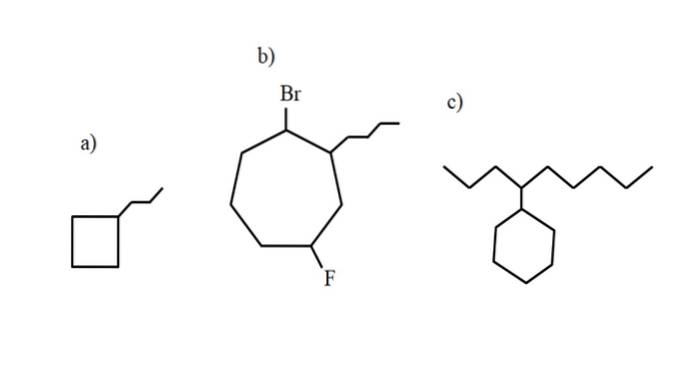
Tyto sloučeniny však mohou podstoupit substituci jednoho ze svých vodíků. Když je počet atomů uhlíku v kruhu větší než počet alkylových substituentů, je kruh považován za hlavní řetězec; to je případ a) pro výše uvedený obrázek.
Všimněte si, že v a) má cyklobutan (čtverec) více uhlíků než k němu připojená propylová skupina; pak je tato sloučenina pojmenována jako propylcyklobutan.
Pokud existuje více než jeden substituent, měly by být pojmenovány v abecedním pořadí a tak, aby měly nejnižší možné číslo lokátoru. Například b) se nazývá: 1-brom-4-fluor-2-butylcykloheptan (a nikoli 1-brom-5-fluor-7-butylcykloheptan, což by bylo nesprávné).
A konečně, když má alkylový substituent více uhlíků než kruh, pak se o něm říká, že je skupinou substituentů hlavního řetězce. Proto se c) nazývá: 4-cyklohexylnonan.
Struktura
Ponecháme-li stranou substituované cykloalkany, je vhodné zaměřit se pouze na jejich strukturní báze: prstence. Ty byly zobrazeny na prvním obrázku.
Jejich pozorování může vést k mylné představě, že takové molekuly jsou ploché; ale s výjimkou cyklopropanu jsou jeho povrchy „klikaté“ a uhlíky stoupají nebo klesají ve vztahu ke stejné rovině.
Je to proto, že všechny uhlíky jsou nejprve hybridizovány sp.3, a proto představují čtyřboké geometrie s úhly vazby 109,5 °. Pokud je však pečlivě sledována geometrie prstenů, je nemožné, aby jejich úhly byly tyto; například úhly uvnitř trojúhelníku cyklopropanu jsou 60 °.
Toto je známé jako úhlové napětí. Čím větší jsou prstence, úhel mezi vazbami C-C je blíže 109,5 °, což způsobuje snížení uvedeného napětí a zvýšení stability pro cykloalkan..
Dalším příkladem je cyklobutan, jehož vazebné úhly jsou 90 °. Již v cyklopentanu jsou jeho úhly 108 ° a z cyklohexanu se říká, že úhlové napětí přestane mít tak pozoruhodný destabilizující účinek.
Konformace
Kromě úhlového stresu existují další faktory, které přispívají ke stresu, který zažívají cykloalkany..
Vazby C-C se nemohou jednoduše otáčet, protože by to znamenalo, že by se celá struktura „otřásla“. Tyto molekuly tedy mohou přijímat velmi dobře definované prostorové konformace. Účelem těchto pohybů je snížit napětí způsobené zatměním atomů vodíku; to znamená, když jsou před sebou.
Například konformace pro cyklobutan připomínají motýla mávajícího křídly; ty z cyklopentanu, obálka; cyklohexan, loď nebo křeslo, a čím větší prsten, tím větší počet a tvary mohou ve vesmíru zaujmout.
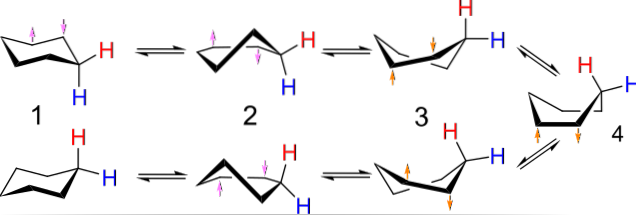
Obrázek výše ukazuje příklad takových konformací pro cyklohexan. Všimněte si, že předpokládaný plochý šestiúhelník ve skutečnosti vypadá spíše jako židle (vlevo na obrázku) nebo loď (vpravo). Jeden vodík je reprezentován červeným písmenem a druhý modrým písmenem, což naznačuje, jak se jejich relativní polohy mění po inverzích..
V bodě (1), když je vodík kolmý na rovinu prstence, se říká, že je v axiální poloze; a když je to paralelní, říká se, že je v rovníkové poloze.
Reakce
Reakce, které mohou cykloalkany podstoupit, jsou stejné jako u alkanů. Oba hoří v přítomnosti přebytečného kyslíku při typických spalovacích reakcích za vzniku oxidu uhličitého a vody. Podobně mohou oba podstoupit halogenace, ve kterých je vodík nahrazen atomem halogenu (F, Cl, Br, I).
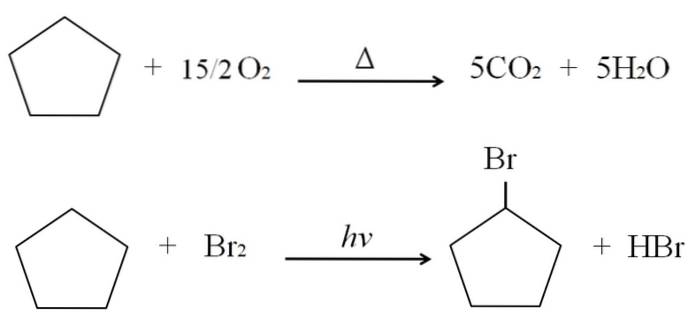
Spalovací a halogenační reakce pro cyklopentan jsou uvedeny na příkladu výše. Jeden jeho mol hoří v přítomnosti tepla a 7,5 mol molekulárního kyslíku se rozkládá na COdva a HdvaO. Na druhou stranu v přítomnosti ultrafialového záření a bromu nahrazuje H za Br a uvolňuje plynnou molekulu HBr.
Aplikace
Použití cykloalkanů je vysoce závislé na jejich počtu uhlíků. Nejlehčí, a proto plynné, se kdysi používaly k napájení plynových lamp veřejného osvětlení.
Kapaliny jsou zase použitelné jako rozpouštědla pro oleje, tuky nebo komerční produkty nepolární povahy. Z nich lze zmínit cyklopentan, cyklohexan a cykloheptan. Podobně mají tendenci být velmi často používány při rutinních operacích v ropných laboratořích nebo při výrobě paliv..
Pokud jsou těžší, lze je použít jako maziva. Na druhou stranu mohou také představovat výchozí materiál pro syntézu léčiv; jako je karboplatina, která ve své struktuře zahrnuje cyklobutanový kruh.
Příklady cykloalkanů
Nakonec se vrátíme na začátek článku: obrázek s několika nesubstituovanými cykloalkany.
Pokud si chcete cykloalkany zapamatovat, pomyslete na geometrické obrazce: trojúhelník (cyklopropan), čtverec (cyklobutan), pětiúhelník (cyklopentan), šestiúhelník (cyklohexan), heptagon (cykloheptan), dekagon (cyklodecane), pentadecagon (cyklopentadecane) atd..
Čím větší je prsten, tím méně se podobá příslušnému geometrickému obrazci. Již bylo vidět, že cyklohexan je něco jiného než šestiúhelník; totéž je patrnější u cyklotetradekanu (čtrnáct uhlíků).
Nastává bod, kdy se budou chovat jako náhrdelníky, které lze složit, aby se co nejvíce snížilo napětí jejich článků a zákrytů..
Reference
- Morrison, R. T. a Boyd, R, N. (1987). Organická chemie. 5. vydání. Redakční Addison-Wesley Interamericana.
- Carey F. (2008). Organická chemie. (Šesté vydání). Mc Graw Hill.
- Graham Solomons T.W., Craig B.Fryhle. (2011). Organická chemie. Miny. (10. vydání.). Wiley plus.
- Chemistry LibreTexts. (2. června 2019). Pojmenování cykloalkany. Obnoveno z: chem.libretexts.org
- Wikipedia. (2019). Cykloalkan. Obnoveno z: en.wikipedia.org
- Clark Jim. (2015). Představujeme alkany a cykloalkany. Obnoveno z: chemguide.co.uk
- James Ashenhurst. (2019). Konformace a cykloalkany. Mistr v organické chemii. Obnoveno z: masterorganicchemistry.com
- Fernández Germán. (s.f.). Teorie cykloalkanů. Organická chemie. Obnoveno z: quimicaorganica.org


Zatím žádné komentáře