
Struktura cyklobutanu, vlastnosti, použití a syntéza

The cyklobutan je uhlovodík sestávající z cykloalkanu se čtyřmi uhlíky, jehož molekulární vzorec je C4H8. Může se také nazývat tetramethylen, vzhledem k tomu, že jsou to čtyři CH jednotkydva které tvoří prsten se čtvercovou geometrií, ačkoli název cyklobutan je přijatelnější a známější.
Při pokojové teplotě je to bezbarvý hořlavý plyn, který hoří jasným plamenem. Jeho nejprimitivnější použití je jako zdroj tepla při jeho spalování; Jeho strukturální základna (čtverec) však zahrnuje hluboké biologické a chemické aspekty a určitým způsobem spolupracuje s vlastnostmi těchto sloučenin..
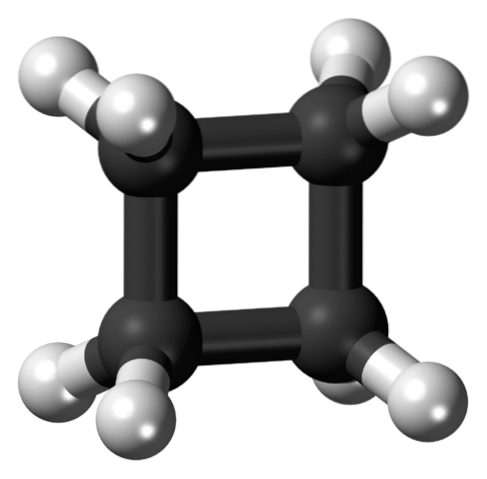
Horní obrázek ukazuje cyklobutanovou molekulu se čtvercovou strukturou. V následující části vysvětlíme, proč je tato konformace nestabilní, protože její vazby jsou napjaté..
Po cyklopropanu je to nejstabilnější cykloalkan, protože čím menší je velikost kruhu, tím reaktivnější bude. Podle toho je cyklobutan nestabilnější než cykly pentan a hexan. Je však zvědavé sledovat ve svých derivátech jádro nebo čtvercové srdce, které, jak bude vidět, je dynamické.
Rejstřík článků
- 1 Struktura cyklobutanu
- 1.1 Motýlí nebo zvrásněné konformace
- 1.2 Intermolekulární interakce
- 2 Vlastnosti
- 2.1 Fyzický vzhled
- 2.2 Molekulová hmotnost
- 2.3 Bod varu
- 2.4 Teplota tání
- 2.5 Bod vzplanutí
- 2.6 Rozpustnost
- 2.7 Hustota
- 2.8 Hustota par
- 2.9 Tlak par
- 2.10 Index lomu
- 2.11 Entalpie spalování
- 2.12 Teplo formace
- 3 Syntéza
- 4 použití
- 5 Reference
Struktura cyklobutanu
Na prvním obrázku se ke struktuře cyklobutanu přistupovalo jako na jednoduchý karbonizovaný a hydrogenovaný čtverec. Na tomto dokonalém čtverci však orbitaly trpí silným zvratem ze svých původních úhlů: jsou odděleny úhlem 90 ° ve srovnání s 109,5 ° pro atom uhlíku se sp hybridizací.3 (úhlové napětí).
Atomy uhlíku sp3 jsou čtyřstěnné a pro některé čtyřstěny by bylo obtížné natolik ohnout jejich orbitaly, aby vytvořily úhel 90 °; ale bylo by to ještě více u uhlíků s hybridizací spdva (120 °) a sp (180 °) se liší od svých původních úhlů. Z tohoto důvodu má cyklobutan sp atomy uhlíku3 v podstatě.
Atomy vodíku jsou také velmi blízko u sebe, zastíněny ve vesmíru. To má za následek zvýšení sterické zábrany, která oslabuje předpokládaný čtverec kvůli jeho vysokému torznímu namáhání..
Proto úhlová a torzní napětí (zapouzdřená v termínu „kruhové napětí“) činí tuto konformaci za normálních podmínek nestabilní..
Molekula cyklobutanu se bude snažit snížit oba pnutí, a aby toho dosáhla, přijímá to, co je známé jako motýlí nebo svraštělá konformace..
Motýlí nebo zvrásněné konformace
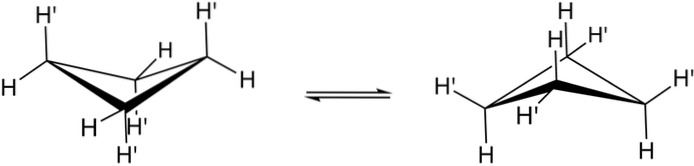
Skutečné konformace cyklobutanu jsou uvedeny výše. V nich úhlové a torzní napětí klesá; protože, jak je vidět, nyní nejsou zastíněny všechny atomy vodíku. Existují však náklady na energii: úhel jeho článků je zostřen, to znamená, že klesá z 90 na 88 °.
Všimněte si, že to lze přirovnat k motýlu, jehož trojúhelníková křídla jsou tvořena třemi atomy uhlíku; a čtvrtý, umístěný v úhlu 25 ° vzhledem ke každému křídlu. Obousměrné šipky označují, že mezi oběma konforméry existuje rovnováha. Je to, jako by motýl spadl a zvedl křídla.
U derivátů cyklobutanu se naopak očekává, že toto mávání bude mnohem pomalejší a prostorově omezené..
Intermolekulární interakce
Předpokládejme, že na chvíli na čtverce zapomenete a místo nich budou nahrazeny sycenými motýly. Ty v jejich mávání mohou být drženy pohromadě pouze v kapalině londýnskými disperzními silami, které jsou úměrné ploše jejich křídel a jejich molekulové hmotnosti..
Vlastnosti
Fyzický vzhled
Bezbarvý plyn.
Molekulová hmotnost
56,107 g / mol.
Bod varu
12,6 ° C Za chladných podmínek by se s ním tedy dalo zacházet v zásadě jako s jakoukoli kapalinou; s jediným detailem, že by byl vysoce volatilní a jeho páry by stále představovaly riziko, které je třeba vzít v úvahu.
Bod tání
-91 ° C.
bod vznícení
50 ° C uzavřená sklenice.
Rozpustnost
Nerozpustný ve vodě, což není překvapivé vzhledem k jeho nepolární povaze; ale je mírně rozpustný v alkoholech, etheru a acetonu, což jsou méně polární rozpouštědla. Očekává se, že bude logicky rozpustný (i když se neuvádí) v nepolárních rozpouštědlech, jako je tetrachlormethan, benzen, xylen atd..
Hustota
0,7125 při 5 ° C (ve vztahu k 1 vodě).
Hustota par
1,93 (ve vztahu k 1 vzduchu). To znamená, že je hustší než vzduch, a proto, pokud nebudou proudy, nebude mít tendenci stoupat..
Tlak páry
1180 mmHg při 25 ° C.
Index lomu
1,3625 při 290 ° C.
Entalpie spalování
-655,9 kJ / mol.
Teplo formace
6,6 Kcal / mol při 25 ° C.
Syntéza
Cyklobutan je syntetizován hydrogenací cyklobutadienu, jehož struktura je téměř stejná, pouze s tím rozdílem, že má dvojnou vazbu; a proto je ještě reaktivnější. Toto je možná nejjednodušší syntetická cesta, jak ji získat, nebo alespoň jen k ní a ne k derivátu.
V ropě je nepravděpodobné, že by ji získal, protože by nakonec reagoval takovým způsobem, že rozbije kruh a vytvoří řetěz, tj. N-butan.
Další metoda k získání cyklobutanu spočívá v úderu ultrafialového záření na molekuly ethylenu, CHdva= CHdva, které dimerizují. Tato reakce je upřednostňována fotochemicky, ale ne termodynamicky:
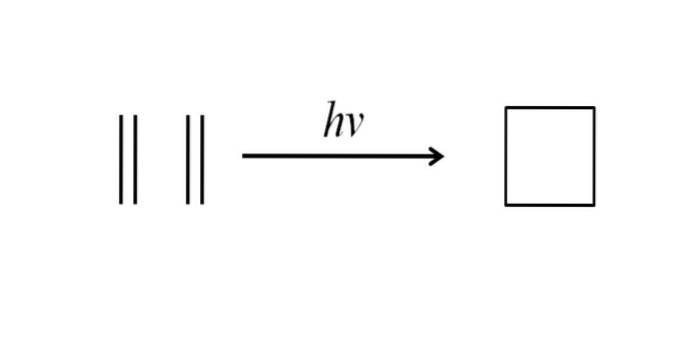
Obrázek nahoře velmi dobře shrnuje to, co bylo řečeno v předchozím odstavci. Pokud by místo ethylenu měl člověk například nějaké dva alkeny, získal by se substituovaný cyklobutan; nebo co je stejné, derivát cyklobutanu. Ve skutečnosti bylo touto metodou syntetizováno mnoho derivátů se zajímavými strukturami..
Jiné deriváty však zahrnují řadu složitých syntetických kroků. Proto jsou cyklobutany (jak se jejich deriváty nazývají) předmětem studia organických syntéz..
Aplikace
Samotný cyklobutan nemá jiné využití, než sloužit jako zdroj tepla; ale jeho deriváty vstupují do složitého terénu v organické syntéze s aplikacemi ve farmakologii, biotechnologii a medicíně. Bez ponoření se do příliš složitých struktur jsou příklady cyklobutanů penitremy a grandisol.
Cyklobutany mají obecně vlastnosti, které jsou prospěšné pro metabolismus bakterií, rostlin, mořských bezobratlých a hub. Jsou biologicky aktivní, a proto je jejich použití velmi rozmanité a obtížně specifikovatelné, protože každé z nich má svůj zvláštní účinek na určité organismy..
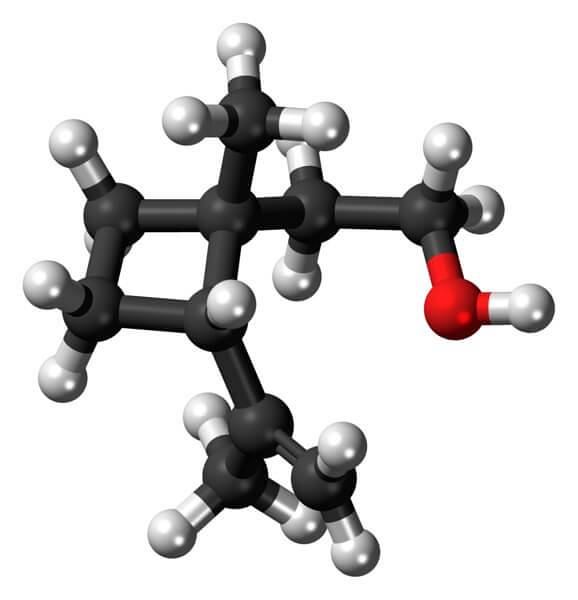
Například Grandisol je feromon z nosatce (druh brouka). Nahoře a nakonec je ukázána jeho struktura, považovaná za monoterpen se čtvercovou základnou cyklobutanu.
Reference
- Carey F. (2008). Organická chemie. (Šesté vydání). Mc Graw Hill.
- Graham Solomons, T. W.; Craig B. Fryhle. (2011). Organická chemie. (jedenáctth edice). Wiley.
- Wikipedia. (2019). Cyklobutan. Obnoveno z: en.wikipedia.org
- PubChem. (2019). Cyklobutan. Obnoveno z: pubchem.ncbi.nlm.nih.gov
- Peiris Nicole. (2015, 29. listopadu). Fyzikální vlastnosti cykloalkanů. Chemistry LibreTexts. Obnoveno z: chem.libretexts.org
- Wiberg B. Kenneth. (2005). Cyklobutan-fyzikální vlastnosti a teoretické studie. Katedra chemie, Yale University.
- Klement Foo. (s.f.). Cyklobutany v organické syntéze. Obnoveno z: scripps.edu
- Myers. (s.f.). Syntéza cyklobutanů. Chem 115. Obnoveno z: hwpi.harvard.edu



Zatím žádné komentáře