
Vlastnosti, rizika a použití kyseliny arsenité (H3AsO3)
The kyselina arsenitá je to anorganická sloučenina vzorce H3AsO3. Jeho struktura je analogická trihydroxyaminu a lze jej přepsat jako As (OH) 3. Je ve vodné formě a nebylo možné jej izolovat v čistém pevném stavu. Jeho struktura je uvedena na obrázku 1.
Výroba As (OH) 3 vyžaduje pomalou hydrolýzu oxidu arsenitého ve vodě. Součet báze převádí kyselinu arzenitou na ionty arsenitu: [AsO (OH) 2] -, [AsO2 (OH)] 2- a [AsO3] 3-.
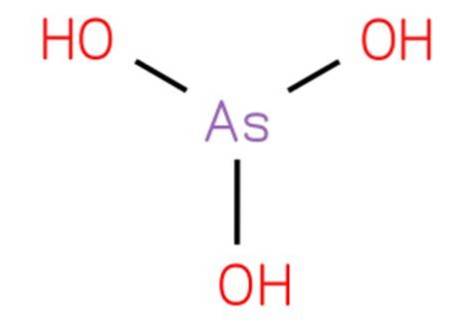
Je to slabá kyselina. Reakce přisuzované vodnému oxidu arzenitému jsou způsobeny kyselinou arsenovou a jejími konjugovanými bázemi.
Rejstřík článků
- 1 Fyzikální a chemické vlastnosti kyseliny arsenité
- 2 Reaktivita a nebezpečí
- 2.1 V případě kontaktu s očima
- 2.2 V případě kontaktu s pokožkou
- 2.3 V případě požití
- 2.4 V případě vdechnutí
- 3 použití
- 4 Odkazy
Fyzikální a chemické vlastnosti kyseliny arsenité
Kyselina arsenitá je pyramidová molekula skládající se ze tří hydroxylových skupin připojených k arsenu. Spektrum 'H NMR roztoků kyseliny arsenové se skládá z jediného signálu v souladu s vysokou symetrií molekuly. Existuje pouze ve vodném roztoku.
Uvedený roztok je bezbarvý a nemá žádnou charakteristickou vůni. Je uložen v jantarových nádobách, aby se zabránilo reakci s UV zářením (National Center for Biotechnology Information, 2017).

Jeho molekulová hmotnost je 125,94 g / mol. I když sloučenina nebyla izolována, její vlastnosti byly vypočítány pomocí výpočetních metod (© Royal Society of Chemistry, 2015), přičemž bylo zjištěno, že má teplotu tání 271,52 ° C, teplotu varu 626,14 ° C a rozpustnost ve vodě 1 x 106 mg / l při 25 ° C.
Sloučenina má pKa 9,2 pro reakci:
H3AsO3 ⇌ H2AsO3- + H+
Literatura uvádí, že sloučenina má amfoterní charakter, i když disociuje jako báze v menší míře, než disociuje jako kyselina, přičemž báze má pro reakci pKb 14:
Jako (OH) 3 ⇌ Jako (OH) 2+ + OH-
To vede k tvorbě druhů, jako jsou kyselé hydroxidy sírany arsenu (As (OH) (HSO4) +, As (OH) 2 (HSO4)) v koncentrovaných roztocích kyseliny sírové, nebo k tvorbě síranu arsenitého (As (HSO4) ) 3) v dýmavých roztocích kyseliny sírové.
Kyselina arsenová může působit jako oxidační činidlo nebo redukční činidlo a zůstává jako elementární arsen nebo kyselina arsenová podle poloreakcí:
H3AsO3 + 3H + + 3e- → As + 3 H2O (ξ0 = +0,240 V)
H3AsO3 + H2O → H3AsO4 + 2H + + 2e- (ξ0 = -0,560 V)
Kyselina arzenitá je silnějším oxidačním činidlem než její fosfonní protějšek, ale slabším redukčním činidlem než ona (Egon Wiberg, 2001).
Reaktivita a nebezpečí
Kyselina arsenitá je sloučenina klasifikovaná jako stabilní, je to však toxické a korozivní činidlo.
Sloučenina má při vystavení teplu nebo plameni zanedbatelné nebezpečí požáru a výbuchu. V takovém případě je třeba s nádobou pokud možno pohnout, vyvarovat se vdechování par nebo prachu..
Při zahřátí sloučenina uvolňuje toxické a korozivní výpary oxidu arsenitého. Měl by být použit samostatný dýchací přístroj a ochranný oděv, aby se zabránilo kontaktu v případě požáru.
Může dráždit oči, kůži a sliznice. Může způsobit senzibilizaci. Otrava může ovlivnit centrální nervový, gastrointestinální a kardiovaskulární systém, játra a ledviny. Sloučeniny obsahující arsen jsou vysoce toxické a karcinogenní.
V případě kontaktu s očima
Omyjte velkým množstvím vody po dobu nejméně 15 minut, příležitostně zvedněte víčka, dokud nejsou patrné zbytky chemikálií.
V případě kontaktu s pokožkou
Okamžitě omyjte velkým množstvím mýdla a vody po dobu nejméně 15 minut, přičemž sundejte kontaminovaný oděv a obuv. Popáleniny jsou pokryty suchým sterilním obvazem (bezpečný, ne těsný).
V případě požití
Oběti, které jsou při vědomí, by mělo být podáno velké množství vody, aby se kyselina zředila. Nepoužívejte výplach žaludku ani nevyvolávejte zvracení. Zdravotnický personál musí udržovat dýchací cesty a dýchat.
V případě vdechnutí
V případě potřeby by mělo být poskytnuto umělé dýchání. Přemístěte postiženého na chladné místo, udržujte jej v teple a klidu.
Ve všech případech je třeba vyhledat okamžitou lékařskou pomoc (Bezpečnostní list materiálu, roztok kyseliny arsenité, 2007).
Aplikace
Kyselina arzenitá se používá k detekci malého množství jódu nebo sloučenin jódu. V práci (Weegh, 1972) byly studovány některé aspekty cerické reakce kyseliny arsenové se zaměřením na optické vlastnosti roztoků ceru..
Rovněž byly studovány kinetické účinky různých sloučenin, zejména účinky chloridových a bromidových iontů a kinetické účinky chloridů nebo bromidů v kombinaci s jodidem..
Kyselinu arsenovou lze také nelegálně použít k potratům (Trend, 1858).
Kyselina arsenitá reaguje při zahřátí za vzniku oxidu arzenitého (As2O3). Tato sloučenina je také běžně známá pod názvem kyselina arsenitá, přestože to není stejná sloučenina. Struktura oxidu arzenitého je uvedena na obrázku 3.
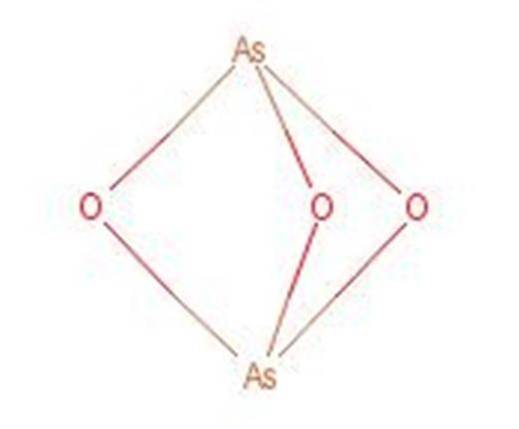
Obrázek 1: Struktura oxidu arzenitého.
Tato sloučenina, známá také jako Trisenox, se používá k léčbě pacientů s leukémií, kteří nereagovali na jiné látky. Tento lék je schválen pro použití americkým Úřadem pro kontrolu potravin a léčiv (FDA) jako léčba leukémie..
Jak sloučenina funguje, je nejasné. Může způsobit morfologické změny a fragmentaci DNA v buňkách promyelocytové leukémie, což způsobí buněčnou smrt a degradaci nebo poškození PML / RAR alfa (fúzní protein) (Nurse's Drug Handbook 7. vydání, 2013).
Protože je pro lidské tělo jedovatý, je jednou z vysoce diskutabilních drog v této oblasti. Oxid arzenitý byl poprvé použit jako tradiční čínská medicína zvaná Pi Shuang. Dodnes se používá k léčbě pacientů s rakovinou a jiných zdravotních stavů. (Arsenious acid review, 2007-2016).
Reference
- © Royal Society of Chemistry. (2015). Kyselina arsenitá. Obnoveno z chemspidera.
- © Royal Society of Chemistry. (2015). Trihydroxyamin. Obnoveno z chemspidera.
- Recenze kyseliny arseniové. (2007-2016). Obnoveno z Medicalook.
- Kyselina arsenitá. (2014, 28. července). Obnoveno z ebi.ac.uk.
- Egon Wiberg, N. W. (2001). Anorganická chemie. Berlín: akademický tisk.
- Bezpečnostní list materiálu Roztok kyseliny arsenité. (2007, 10. září). Obnoveno z t3db.ca.
- Národní centrum pro biotechnologické informace. (2017, 4. března). Složená databáze PubChem; CID = 545,. Citováno z PubChem.
- Nurse's Drug Handbook 7. vydání (2013). McGraw-Hill.
- Trend, H. G. (1858). Případ, ve kterém byla kyselina arsenitá použita k získání potratu. britský lékařský deník původní sdělení, 725-726.
- Weegh, W. H. (1972). Využití reakce kyseliny ceričité s kyselinou arsenitou pro stanovení malého množství jodu nebo sloučenin jodu. Clinica Chimica Acta, svazek 39, vydání 2, 327-338.



Zatím žádné komentáře