
Struktura, vlastnosti, výroba a použití kyseliny citronové
The kyselina citronová je organická sloučenina sestávající ze slabé kyseliny, jejíž chemický vzorec je C6H8NEBO7. Jak název napovídá, jedním z jeho hlavních přírodních zdrojů jsou citrusové plody a pochází také z latinského slova „citrus“, což znamená hořký..
Nejen, že je to slabá kyselina, je také polyprotická; to znamená, že může uvolňovat více než jeden vodíkový iont, H+. Je to přesně trikarboxylová kyselina, takže má tři -COOH skupiny, které darují ionty H+. Každý z nich má vlastní tendenci uvolňovat se do svého prostředí..

Proto je jeho strukturní vzorec lépe definován jako C3H5O (COOH)3. To je chemický důvod pro jeho příspěvek k charakteristické chuti například oranžových segmentů. Ačkoli pochází z ovoce, jeho krystaly byly izolovány až v roce 1784 z citronové šťávy v Anglii.
Tvoří přibližně 8% hmotnostních některých citrusových plodů, jako jsou citrony a grapefruity. Naleznete jej také v paprikách, rajčatech, artyčoku a dalších potravinách..
Rejstřík článků
- 1 Kde se nachází kyselina citronová?
- 2 Struktura kyseliny citronové
- 2.1 Intermolekulární interakce
- 3 Fyzikální a chemické vlastnosti
- 3.1 Molekulová hmotnost
- 3.2 Fyzický vzhled
- 3.3 Příchuť
- 3.4 Bod tání
- 3.5 Bod varu
- 3.6 Hustota
- 3.7 Rozpustnost
- 3,8 pKa
- 3.9 Rozklad
- 3.10 Deriváty
- 4 Výroba
- 4.1 Chemická nebo syntetická syntéza
- 4.2 Přírodní
- 4.3 Kvašením
- 5 použití
- 5.1 V potravinářském průmyslu
- 5.2 Ve farmaceutickém průmyslu
- 5.3 V kosmetickém průmyslu a obecně
- 6 Toxicita
- 7 Reference
Kde se nachází kyselina citronová?
Nachází se v nízkých poměrech u všech rostlin a živočichů a je to metabolit živých bytostí. Jedná se o meziprodukt aerobního metabolismu přítomný v cyklu trikarboxylové kyseliny nebo v cyklu kyseliny citronové. V biologii nebo biochemii je tento cyklus znám také jako Krebsův cyklus, amfibolická cesta metabolismu.
Kromě toho, že se tato kyselina přirozeně vyskytuje v rostlinách a zvířatech, získává se synteticky ve velkém měřítku fermentací..
Je široce používán v potravinářském průmyslu, ve farmaceutických a chemických přípravcích a chová se jako přírodní konzervační prostředek. To a jeho deriváty se masivně vyrábějí na průmyslové úrovni k aromatizaci pevných a tekutých potravin.
Najde použití jako přísada do odrůd kosmetických výrobků pro pleť; používá se také jako chelatační, okyselující a antioxidační činidlo. Jeho použití ve vysokých nebo čistých koncentracích se však nedoporučuje; protože může způsobit podráždění, alergie a dokonce i rakovinu.
Struktura kyseliny citronové
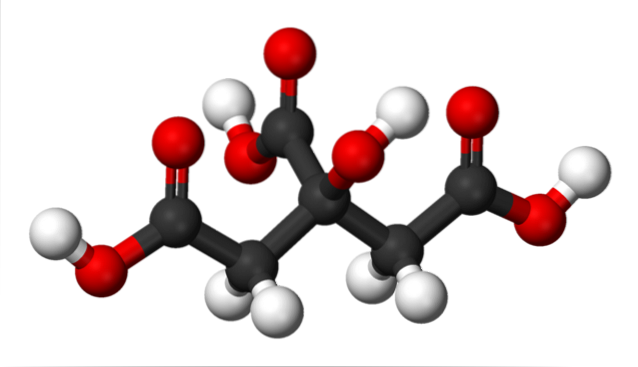
Na horním obrázku je struktura kyseliny citronové znázorněna modelem koulí a pruhů. Pokud se podíváte pozorně, najdete kostru pouhých tří uhlíků: propanu.
Atom uhlíku ve středu je spojen se skupinou -OH, která v přítomnosti karboxylových skupin, -COOH, přejímá terminologii „hydroxy“. Tři skupiny -COOH jsou snadno rozpoznatelné na levém a pravém konci a v horní části struktury; Z nich se uvolňují H+.
Na druhou stranu je -OH skupina také schopná ztratit kyselý proton, takže by celkem nebyly tři H+, ale čtyři. Ten však vyžaduje značně silnou bázi, a proto je jeho příspěvek k charakteristické kyselosti kyseliny citronové mnohem menší ve srovnání s přínosem pro skupiny -COOH..
Ze všeho výše uvedeného vyplývá, že kyselinu citronovou lze také nazvat: 2-hydroxy-1,2,3-trikarboxylová propan.
V C-2 je skupina -OH, která sousedí se skupinou -COOH (podívejte se na horní střed struktury). Z tohoto důvodu spadá kyselina citronová také do klasifikace alfa-hydroxykyselin; kde alfa znamená „sousedící“, to znamená, že existuje pouze jeden atom uhlíku oddělující -COOH a -OH.
Intermolekulární interakce
Jak je vidět, struktura kyseliny citronové má vysokou schopnost darovat a přijímat vodíkové vazby. Díky tomu je velmi příbuzný vodě a také důvodem, proč velmi snadno vytváří monohydrátové pevné, kosodélníkové krystaly..
Tyto vodíkové vazby jsou také zodpovědné za vybudování bezbarvých monoklinických krystalů kyseliny citronové. Bezvodé krystaly (bez vody) lze získat po vytvoření v horké vodě s následným úplným odpařením..
Fyzikální a chemické vlastnosti
Molekulární váha
210,14 g / mol.
Fyzický vzhled
Bezbarvé krystaly kyselin bez zápachu.
Chuť
Kyselé a hořké.
Bod tání
153 ° C.
Bod varu
175 ° C.
Hustota
1,66 g / ml.
Rozpustnost
Je to vysoce rozpustná sloučenina ve vodě. Je také velmi rozpustný v jiných polárních rozpouštědlech, jako je ethanol a ethylacetát. V nepolárních a aromatických rozpouštědlech, jako je benzen, toluen, chloroform a xylen, je nerozpustný.
pKa
-3.1
-4.7
-6.4
Toto jsou hodnoty pKa pro každou ze tří -COOH skupin. Všimněte si, že třetí pKa (6,4) je sotva mírně kyselý, takže se málo disociuje.
Rozklad
Při extrémních teplotách nebo nad 175 ° C se rozkládá a uvolňuje COdva a voda. Proto kapalina nedosahuje významného varu, protože se nejprve rozloží..
Deriváty
Jak ztratíš H+, jiné kationty zaujmou své místo, ale iontovým způsobem; tj. záporné náboje skupin -COO- přilákat další druhy kladných nábojů, například Na+. Čím více je deprotonovaná kyselina citronová, tím více kationtů budou mít její deriváty zvané citráty.
Příkladem je citrát sodný, který má jako koagulant velmi užitečný chelatační účinek. Tyto citráty proto mohou tvořit komplexy s kovy v roztoku..
Na druhou stranu, H+ skupiny -COOH mohou být dokonce substituovány jinými kovalentně vázanými druhy, jako jsou R postranní řetězce, což vede k citrátovým esterům: C3H5NEBO (COOR)3.
Rozmanitost je velmi velká, protože ne všechny H musí být nutně nahrazeny R, ale také kationty.
Výroba
Kyselinu citronovou lze vyrábět přirozeně a komerčně získávanou fermentací sacharidů. Jeho výroba byla také prováděna synteticky chemickými procesy, které dnes nejsou příliš aktuální..
Pro jeho výrobu bylo použito několik biotechnologických procesů, protože tato sloučenina je celosvětově velmi žádaná.
Chemická nebo syntetická syntéza
-Jeden z těchto procesů chemické syntézy se provádí za podmínek vysokého tlaku z vápenatých solí isocitrátu. Šťáva extrahovaná z citrusových plodů se zpracuje hydroxidem vápenatým a získá se citrát vápenatý..
Tato sůl se potom extrahuje a zreaguje se zředěným roztokem kyseliny sírové, jehož funkcí je protonovat citrát do původní kyselé formy..
-Kyselina citronová byla také syntetizována z glycerinu nahrazením jejích složek karboxylovou skupinou. Jak již bylo uvedeno, tyto procesy nejsou optimální pro výrobu kyseliny citronové ve velkém měřítku..
přírodní
V těle se kyselina citronová přirozeně vyskytuje v aerobním metabolismu: cyklus trikarboxylové kyseliny. Když acetyl koenzym A (acetyl-CoA) vstoupí do cyklu, váže se s kyselinou oxalooctovou a tvoří kyselinu citrónovou..
A odkud pochází acetyl-CoA?
Při reakci katabolismu mastných kyselin, sacharidů, mimo jiné substráty, v přítomnosti Odva vyrábí se acetyl-CoA. Vzniká jako produkt beta-oxidace mastných kyselin, transformace pyruvátu generovaného při glykolýze.
Kyselina citronová vytvořená v Krebsově cyklu nebo cyklu kyseliny citronové bude oxidována na kyselinu alfa-ketoglutarovou. Tento proces představuje amfibolickou oxidačně-redukční dráhu, ze které se generují ekvivalenty, které pak budou produkovat energii nebo ATP..
Komerční výroba kyseliny citronové jako meziproduktu aerobního metabolismu však nebyla ani zisková, ani uspokojivá. Pouze za podmínek organické nerovnováhy lze zvýšit koncentraci tohoto metabolitu, který není pro mikroorganismy životaschopný.
Kvašením
Mikroorganismy, jako jsou houby a bakterie, produkují kyselinu citrónovou fermentací cukrů.
Výroba kyseliny citronové z mikrobiální fermentace přinesla lepší výsledky než její získání chemickou syntézou. Byly vyvinuty výzkumné linky související s touto hromadnou komerční metodou výroby, která nabízí velké ekonomické výhody..
Kultivační techniky na průmyslové úrovni se časem měnily. Byly použity kultury pro povrchovou a ponořenou fermentaci. Ponořené kultury jsou ty, ve kterých mikroorganismy produkují fermentaci ze substrátů obsažených v kapalném médiu.
Optimální byly procesy výroby kyseliny citronové ponornou fermentací, ke které dochází za anaerobních podmínek..
Některé houby jako Aspergillus niger, Saccahromicopsis sp, a bakterie jako Bacillus licheniformis, umožnily s tímto typem fermentace dosáhnout vysokého výtěžku.
Houby jako Aspergillus niger nebo candida sp, Produkují kyselinu citrónovou v důsledku fermentace melasy a škrobu. Třtinový, kukuřičný a řepný cukr se mimo jiné také používají jako fermentační substráty..
Aplikace
Kyselina citronová je široce používána v potravinářském průmyslu při výrobě farmaceutických výrobků. Používá se také v nesčetných chemických a biotechnologických procesech..
V potravinářském průmyslu
-Kyselina citronová se používá hlavně v potravinářském průmyslu, protože jim dodává příjemnou kyselou chuť. Je velmi rozpustný ve vodě, proto se přidává do nápojů, sladkostí, cukrovinek, želé a mraženého ovoce. Používá se také při přípravě vín, piv a jiných nápojů..
-Kromě přidání kyselé příchuti deaktivuje stopové prvky a chrání kyselinu askorbovou nebo vitamin C. Působí také jako emulgátor ve zmrzlině a sýrech. Přispívá k deaktivaci oxidačních enzymů snížením pH potravin.
-Zvyšuje účinnost konzervačních látek přidávaných do potravin. Poskytnutím relativně nízkého pH snižuje pravděpodobnost přežití mikroorganismů ve zpracovaných potravinách, čímž zvyšuje jejich trvanlivost..
-V tucích a olejích se kyselina citrónová používá k posílení synergického antioxidačního účinku (všech tukových složek), který tento druh živin může mít..
Ve farmaceutickém průmyslu
-Kyselina citronová se také široce používá jako pomocná látka ve farmaceutickém průmyslu ke zlepšení chuti a rozpouštění léčiv..
-V kombinaci s hydrogenuhličitanem se kyselina citrónová přidává do práškových a tabletových produktů způsobem, který působí jako šumivý.
-Soli kyseliny citronové umožňují její použití jako antikoagulancia, protože má schopnost chelátovat vápník. Kyselina citronová se podává v minerálních doplňcích, jako jsou citrátové soli.
-Okyselením média absorpčního procesu na střevní úrovni optimalizuje kyselina citronová příjem vitamínů a některých léků. Jeho bezvodá forma se podává jako doplněk jiných léčiv při rozpouštění kamenů.
-Používá se také jako okyselující přísada jako látka, která usnadňuje rozpouštění aktivních složek různých farmaceutických produktů..
V kosmetickém průmyslu a obecně
-Kyselina citronová se používá jako chelatační činidlo pro ionty kovů v toaletních a kosmetických přípravcích..
-Používá se k čištění a leštění kovů obecně k odstraňování oxidu, který je pokrývá.
-V nízkých koncentracích slouží jako přísada do ekologických čisticích prostředků, které jsou příznivé pro životní prostředí a přírodu..
-Má širokou škálu použití: používá se ve fotografických činidlech, textiliích, při koželužství.
-Přidává do tiskových barev.
Toxicita
Zprávy o jeho toxicitě jsou mimo jiné spojeny s vysokou koncentrací kyseliny citronové, dobou expozice, nečistotami..
Zředěné roztoky kyseliny citronové nepředstavují žádné riziko ani nebezpečí pro zdraví. Čistá nebo koncentrovaná kyselina citronová však představuje bezpečnostní riziko, a proto by se neměla konzumovat..
Čistý nebo koncentrovaný, je žíravý a dráždivý při kontaktu s pokožkou a sliznicemi očí, nosu a krku. Při požití může vyvolat alergické kožní reakce a akutní toxicitu..
Vdechování čistého prachu z kyseliny citronové může také ovlivnit sliznici dýchacích cest. Vdechnutí může způsobit dušnost, alergie, senzibilizaci dýchací sliznice a může dokonce vyvolat astma.
Hlášeny jsou toxické účinky na reprodukci. Kyselina citronová může způsobit genetické vady a způsobit mutaci v zárodečných buňkách.
A nakonec je považován za nebezpečný nebo toxický pro vodní prostředí a obecně je koncentrovaná kyselina citronová korozivní pro kovy..
Reference
- BellChem (21. dubna 2015). Využití kyseliny citronové v potravinářském průmyslu. Obnoveno z: bellchem.com
- Vandenberghe, Luciana P. S, Soccol, Carlos R, Pandey, Ashok, & Lebeault, Jean-Michel. (1999). Mikrobiální produkce kyseliny citronové. Brazilský archiv biologie a technologie, 42 (3), 263-276. dx.doi.org/10.1590/S1516-89131999000300001
- PubChem. (2018). Kyselina citronová. Obnoveno z: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2018). Kyselina citronová. Obnoveno z: en.wikipedia.org
- Whitten, K., Davis, R., Peck M. a Stanley, G. (2008). Chemie. (8ava. ed). Učení CENGAGE: Mexiko.
- Berovic, M. a Legisa, M. (2007). Výroba kyseliny citronové. Výroční přehled biotechologie. Obnoveno z: researchgate.net



Zatím žádné komentáře