
Vlastnosti, rizika a použití kyseliny fosforečné (H3PO3)

The kyselina fosforitá, také nazývaná kyselina ortofosforečná, je to chemická sloučenina vzorce H3PO3. Je to jedna z různých kyslíkatých kyselin fosforu a její struktura je uvedena na obrázku 1 (EMBL-EBI, 2015).
Vzhledem k vzorci sloučeniny ji lze přepsat jako HPO (OH)dva. Tento druh existuje v rovnováze s malým tautomerem P (OH)3 (Obrázek 2).

Doporučení IUPAC z roku 2005 uvádějí, že druhá se nazývá kyselina fosforitá, zatímco dihydroxyforma se nazývá kyselina fosfonová. Pouze sloučeniny se sníženým obsahem fosforu jsou hláskovány s „medvědí“ koncovkou..

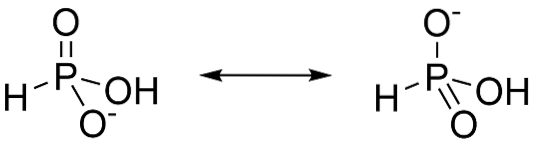
Kyselina fosforitá je kyselina diprotová, to znamená, že má schopnost vzdát se pouze dvou protonů. Je to proto, že většinovým tautomerem je H3PO3. Když tento tvar ztratí proton, rezonance stabilizuje vytvořené anionty, jak je znázorněno na obrázku 3.
Tautomer P (OH) 3 (obrázek 4) nemá výhodu stabilizace rezonance. Díky tomu je odstranění třetího protonu mnohem obtížnější (Proč je kyselina fosforitá diprotická a nikoli triprotická?, 2016).

Kyselina fosforečná (H3PO3) tvoří soli zvané fosfity, které se používají jako redukční činidla (Britannica, 1998). Připravuje se rozpuštěním hexafidu tetraposforečného (P4NEBO6) podle rovnice:
P4NEBO6 + 6 hdvaO → 4 HPO (OH)dva
Čistá kyselina fosforitá, H3PO3, nejlépe připravit hydrolýzou chloridu fosforečného, PCl3.
PCl3 + 3HdvaO → HPO (OH)dva + 3HCl
Výsledný roztok se zahřívá, aby se odvedl HCl, a zbývající voda se odpaří, dokud se neobjeví 3PO3 bezbarvý krystalický při chlazení. Kyselinu lze také získat působením vody na PBr3 nebo PI3 (Zumdahl, 2018).
Rejstřík článků
- 1 Fyzikální a chemické vlastnosti
- 2 Reaktivita a nebezpečí
- 2.1 Reaktivita
- 2.2 Nebezpečí
- 2.3 Opatření v případě poškození
- 3 použití
- 4 Odkazy
Fyzikální a chemické vlastnosti
Kyselina fosforitá jsou bílé nebo žluté hygroskopické čtyřboké krystaly s česnekovou vůní (National Center for Biotechnology Information, 2017).

H3PO3 má molekulovou hmotnost 82,0 g / mol a hustotu 1,651 g / ml. Sloučenina má teplotu tání 73 ° C a rozkládá se nad 200 ° C. Kyselina fosforečná je rozpustná ve vodě a je schopna rozpustit 310 gramů na 100 ml tohoto rozpouštědla. Je také rozpustný v ethanolu.
Kromě toho se jedná o silnou kyselinu s pKa mezi 1,3 a 1,6 (Royal Society of Chemistry, 2015).
Zahřátím kyseliny fosforečné na asi 200 ° C dochází k jejímu neúměrnému rozložení na kyselinu fosforečnou a fosfin (PH3). Fosfin, plyn, který se za normálních okolností spontánně vznítí ve vzduchu.
4H3PO3 + teplo → PH3 + 3H3PO4
Reaktivita a nebezpečí
Reaktivita
- Kyselina fosforitá není stabilní sloučenina.
- Absorbuje kyslík ze vzduchu za vzniku kyseliny fosforečné.
- Ve vodném roztoku tvoří žluté usazeniny, které jsou při sušení spontánně hořlavé.
- Exotermicky reaguje s chemickými bázemi (například: aminy a anorganické hydroxidy) za vzniku solí.
- Tyto reakce mohou v malých prostorech generovat nebezpečně velké množství tepla..
- Rozpuštění ve vodě nebo zředění koncentrovaného roztoku další vodou může generovat značné teplo.
- Reaguje v přítomnosti vlhkosti s aktivními kovy, včetně konstrukčních kovů, jako je hliník a železo, za uvolnění vodíku, hořlavého plynu.
- Může zahájit polymeraci určitých alkenů. Reaguje s kyanidovými sloučeninami za uvolnění plynného kyanovodíku.
- Při kontaktu s dithiokarbamáty, isokyanáty, merkaptany, nitridy, nitrily, sulfidy a silnými redukčními činidly může vytvářet hořlavé a / nebo toxické plyny.
- Další reakce vytvářející plyn se vyskytují se siřičitany, dusitany, thiosírany (za vzniku H2S a SO3), dithionity (za vzniku SO2) a uhličitany (za vzniku CO2) (KYSELINA FOSFOROVÁ, 2016).
Nebezpečí
- Sloučenina je korozivní pro oči a kůži.
- Kontakt s očima může mít za následek poškození rohovky nebo slepotu..
- Kontakt s pokožkou může způsobit zánět a puchýře.
- Vdechování prachu způsobí podráždění gastrointestinálního nebo dýchacího traktu, které je charakterizováno pálením, kýcháním a kašláním..
- Silné nadměrné vystavení může způsobit poškození plic, udušení, ztrátu vědomí nebo smrt (List bezpečnostních údajů o kyselině fosforité, 2013).
Opatření v případě poškození
- Zajistit, aby si zdravotničtí pracovníci byli vědomi použitých materiálů, a učinit preventivní opatření, aby se chránili.
- Oběť by měla být přemístěna na chladné místo a přivolána pohotovostní lékařská služba.
- Pokud oběť nedýchá, mělo by být provedeno umělé dýchání.
- Metoda z úst do úst by se neměla používat, pokud oběť látku požila nebo vdechla..
- Umělé dýchání se provádí pomocí kapesní masky vybavené jednosměrným ventilem nebo jiným vhodným dýchacím lékařským zařízením.
- Pokud je dýchání obtížné, měl by být podán kyslík.
- Kontaminovaný oděv a obuv by měly být odstraněny a izolovány.
- V případě kontaktu s látkou po dobu nejméně 20 minut okamžitě opláchněte pokožku nebo oči tekoucí vodou..
- Pro menší kontakt s pokožkou se vyvarujte šíření materiálu na nedotčenou pokožku..
- Udržujte oběť v klidu a teple.
- Účinky expozice (vdechování, požití nebo kontakt s pokožkou) látce mohou být opožděné.
Aplikace
Nejdůležitějším použitím kyseliny fosforečné je výroba fosfitů, které se používají při úpravě vody. Kyselina fosforečná se také používá k přípravě fosfitových solí, jako je fosforečnan draselný..
Ukázalo se, že fosfity jsou účinné při potlačování různých chorob rostlin.
Zejména léčba injekcí do kmene nebo na list obsahující soli kyseliny fosforečné je indikována v reakci na infekce rostlinnými patogeny typu phytoftera a pythium (způsobují rozklad kořenů).
Kyselina fosforečná a fosfity se používají jako redukční činidla při chemické analýze. Pohodlná a škálovatelná nová syntéza kyselin fenyloctových prostřednictvím jodidem katalyzované redukce mandlových kyselin je založena na generování kyseliny jodovodíkové in situ z katalytického jodidu sodného. K tomu se používá kyselina fosforečná jako stechiometrický reduktor (Jacqueline E. Milne, 2011).
Používá se jako přísada pro výrobu přísad používaných v polyvinylchloridovém průmyslu (kyselina fosforitá (CAS RN 10294-56-1), 2017). Estery kyseliny fosforečné se také používají při různých reakcích organické syntézy (Blazewska, 2009).
Reference
- Blazewska, K. (2009). Science of Synthesis: Houben-Weyl Methods of Molecular Transformations Vol 42. New York: Thieme.
- (1998, 20. července). Kyselina fosforečná (H3PO3). Obnoveno z Encyklopedie Britannica: britannica.com.
- EMBL-EBI. (2015, 20. července). kyselina fosfonová. Obnoveno z ebi.ac.uk: ebi.ac.uk.
- Jacqueline E. Milne, T. S. (2011). Jodidem katalyzované redukce: vývoj syntézy kyselin fenyloctové. Org. Chem. 76, 9519-9524. organická-chemie.org.
- Bezpečnostní list materiálu Kyselina fosforitá. (2013, 21. května). Obnoveno z sciencelab: sciencelab.com.
- Národní centrum pro biotechnologické informace. (2017, 11. března). Složená databáze PubChem; CID = 107909. Citováno z PubChem: ncbi.nlm.nih.gov.
- Kyselina fosforečná (CAS RN 10294-56-1). (2017, 15. března). Obnoveno z gov.uk/trade-tariff:gov.uk.
- KYSELINA FOSFOROVÁ. (2016). Obnoveno z cameochemicals: cameochemicals.noaa.gov.
- Royal Society of Chemistry. (2015). KYSELINA FOSFOROVÁ. Obnoveno z chemspider: chemspider.com.
- Proč je kyselina fosforitá diprotická a nikoli triprotická? (2016, 11. března). Obnoveno z chemistry.stackexchange.
- Zumdahl, S. S. (2018, 15. srpna). Okyselina. Obnoveno z britannica.com.



Zatím žádné komentáře