
Struktura kyseliny chlorné (HClO), vlastnosti, použití, syntéza

The Kyselina chlorná Je to anorganická sloučenina, jejíž chemický vzorec je HClO. Odpovídá nejméně oxidované oxokyselině chloru, protože obsahuje pouze jeden atom kyslíku. Z toho odvozují chlornanový anion, ClO-, a jeho soli, široce používané jako komerční dezinfekční prostředky na vodu.
HClO je nejsilnější oxidační a antimikrobiální činidlo vznikající při rozpouštění plynného chloru ve vodě. Jeho antiseptické působení je známé již více než století, ještě předtím, než byly roztoky chloru použity k čištění ran vojáků v první světové válce..
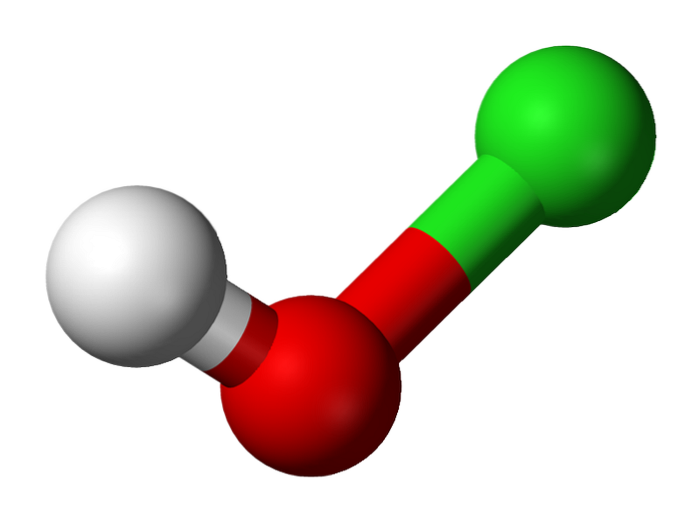
Jeho objev se ve skutečnosti datuje do roku 1834 francouzským chemikem Antoinem Jérômem Balardem, který dosáhl částečné oxidace chloru jeho probubláváním ve vodné suspenzi oxidu rtuti HgO. Od té doby se používá jako dezinfekční prostředek a antivirový prostředek..
Chemicky vzato, HClO je oxidační činidlo, které se nakonec vzdá svého atomu chloru jiným molekulám; Jinými slovy, lze s ním syntetizovat chlorované sloučeniny, přičemž při vývoji nových antibiotik mají velký význam chloraminy..
V 70. letech bylo zjištěno, že tělo je schopné přirozeně produkovat tuto kyselinu působením enzymu myeloperoxidázy; enzym, který během fagocytózy působí na peroxidy a chloridové anionty. Ze stejného organismu tedy může tento „zabiják“ vetřelců vzniknout, ale v neškodném měřítku pro jeho vlastní blaho..
Rejstřík článků
- 1 Struktura
- 2 Vlastnosti
- 2.1 Kyselost
- 2.2 Oxidační činidlo
- 2.3 Stabilita
- 3 Syntéza
- 3.1 Voda a chlor
- 3.2 Elektrolýza
- 4 použití
- 4.1 Obecné aspekty
- 4.2 Dezinfekce a čištění
- 5 Rizika
- 6 Reference
Struktura
Horní obrázek ukazuje strukturu HClO. Všimněte si, že vzorec je v rozporu se strukturou: molekula je H-O-Cl a ne H-Cl-O; posledně jmenovaný je však obvykle upřednostňován, aby bylo možné jej přímo porovnat s jeho oxidovanějšími protějšky: HClOdva, HClO3 a HClO4.
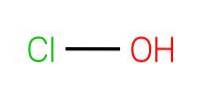
Kyselý vodík, H+, uvolněný HClO se nachází na OH skupině připojené k atomu chloru. Všimněte si také pozoruhodných rozdílů v délce vazeb O-H a Cl-O, přičemž posledně jmenované jsou nejdelší z důvodu menšího stupně překrytí chlorových orbitalů, difúznějších, s kyslíkovými..
Molekula HOCl může za normálních podmínek těžko zůstat stabilní; nemůže být izolován z jeho vodných roztoků, aniž by byl nepřiměřený nebo uvolněný jako plynný chlor, Cldva.
Proto neexistují žádné bezvodé krystaly (ani jejich hydráty) kyseliny chlorné; A doposud také nic nenasvědčuje tomu, že by mohly být připraveny extravagantními metodami. Pokud by mohly krystalizovat, molekuly HClO by vzájemně interagovaly prostřednictvím svých permanentních dipólů (negativní náboje orientované na kyslík).
Vlastnosti
Kyselost
HClO je kyselina monoprotová; to znamená, že můžete darovat pouze jedno H+ do vodného média (kde se tvoří):
HClO (vod.) + HdvaO ↔ ClO-(ac) + H3NEBO+(ac) (pKa = 7,53)
Z této rovnovážné rovnice lze pozorovat pokles iontů H3NEBO+ (zvýšení zásaditosti média) upřednostňuje tvorbu více chlornanových aniontů, ClO-. V důsledku toho, pokud chcete udržet řešení ClO relativně stabilní- pH musí být zásadité, čehož je dosaženo pomocí NaOH.
Jeho disociační konstanta, pKa, zpochybňuje, že HClO je slabá kyselina. Při koncentrované manipulaci byste se tedy nemuseli tolik starat o ionty H.3NEBO+, ale samotným HClO (vzhledem k jeho vysoké reaktivitě a ne kvůli jeho žíravosti).
Oxidační činidlo
Bylo zmíněno, že atom chloru v HClO má oxidační číslo +1. To znamená, že stěží vyžaduje zisk jediného elektronu, aby se vrátil do základního stavu (Cl0) a být schopen tvořit molekulu Cldva. V důsledku toho se HClO sníží na Cldva a HdvaNebo rychlejší oxidaci jiného druhu ve srovnání se stejným Cldva nebo ClO-:
2HClO (aq) + 2H+ + 2e- ↔ Cldva(g) + 2HdvaO (l)
Tato reakce nám již umožňuje zjistit, jak stabilní je HClO ve vodných roztocích..
Jeho oxidační síla se neměřuje pouze tvorbou Cldva, ale také kvůli své schopnosti vzdát se atomu chloru. Například může reagovat s dusíkatými látkami (včetně amoniaku a dusíkatých bází) za vzniku chloraminů:
HClO + N-H → N-Cl + HdvaNEBO
Povšimněte si, že N-H vazba aminoskupiny (-NHdva) většinou a je nahrazen jedním N-Cl. Totéž se děje s O-H vazbami hydroxylových skupin:
HClO + O-H → O-Cl + HdvaNEBO
Tyto reakce jsou zásadní a vysvětlují dezinfekční a antibakteriální účinek HClO..
Stabilita
HClO je nestabilní téměř všude, kam se na něj podíváte. Například chlornanový anion je nepřiměřený u druhů chloru s oxidačními čísly -1 a +5, stabilnější než +1 v HClO (H+Cl+NEBOdva-):
3ClO-(aq) ↔ 2Cl-(ac) + ClO3-(ac)
Tato reakce by znovu posunula rovnováhu směrem ke zmizení HClO. Podobně se HClO účastní přímo v paralelní rovnováze s vodou a plynným chlórem:
Cldva(g) + HdvaO (l) ↔ HClO (aq) + H+(ac) + Cl-(ac)
Proto pokus o zahřátí roztoku HClO za účelem jeho koncentrování (nebo jeho izolace) vede k produkci Cldva, který je identifikován jako žlutý plyn. Stejně tak nemohou být tato řešení vystavena příliš dlouho světlu ani přítomnosti oxidů kovů, protože rozkládají Cldva (HClO zmizí ještě více):
2Cldva + 2HdvaO → 4HCl + Odva
HCl reaguje s HClO za vzniku více Cldva:
HClO + HCl → Cldva + HdvaNEBO
A tak dále, dokud už nebude žádný HClO.
Syntéza
Voda a chlor
Jeden ze způsobů přípravy nebo syntézy kyseliny chlorné již byl implicitně vysvětlen: rozpouštění plynného chloru ve vodě. Další docela podobná metoda spočívá v rozpuštění anhydridu této kyseliny ve vodě: dichlormonoxid, CldvaNEBO:
CldvaO (g) + HdvaO (l) ↔ 2HClO (aq)
Opět neexistuje způsob, jak izolovat čistý HClO, protože odpařováním vody by se rovnováha posunula na tvorbu CldvaNebo plyn, který unikne z vody.
Na druhou stranu bylo možné připravit koncentrovanější roztoky HClO (20%) za použití oxidu rtuťnatého, HgO. Za tímto účelem se chlor rozpustí v objemu vody těsně při bodu mrazu tak, že se získá chlorovaný led. Pak se tentýž led míchá a při tavení se mísí s HgO:
2Cldva + HgO + 12HdvaO → 2HClO + HgCldva + 11HdvaNEBO
20% roztok HClO může být nakonec vakuově destilován.
Elektrolýza
Jednodušší a bezpečnější způsob přípravy roztoků kyselin chlorných je použití solanky jako suroviny místo chloru. Solanky jsou bohaté na chloridové anionty, Cl-, které mohou být elektrolýzou oxidovány na Cldva:
2HdvaO → Odva + 4H+ + 4e-
2Cl- ↔ 2e- + Cldva
K těmto dvěma reakcím dochází na anodě, kde se vyrábí chlor, který se okamžitě rozpouští za vzniku HClO; zatímco v katodovém prostoru je voda snížena:
2HdvaO + 2e- → 2OH- + Hdva
Tímto způsobem může být HClO syntetizován v komerčním až průmyslovém měřítku; a tyto roztoky získané ze solných roztoků jsou ve skutečnosti komerčně dostupnými produkty této kyseliny.
Aplikace
Obecné znaky
HClO lze použít jako oxidační činidlo k oxidaci alkoholů na ketony a k syntéze chloraminů, chloramidů nebo chlorhydrinů (počínaje alkeny).
Všechna jeho další použití však lze shrnout do jednoho slova: biocid. Zabírá houby, bakterie, viry a neutralizuje toxiny uvolňované patogeny.
Imunitní systém našeho těla syntetizuje svůj vlastní HClO působením enzymu myeloperoxidázy, což pomáhá bílým krvinkám vymýtit vetřelce, kteří způsobují infekci.
Nesčetné studie naznačují různé mechanismy působení HClO na biologickou matrici. To daruje svůj atom chloru na aminoskupiny určitých proteinů a také oxiduje jejich přítomné skupiny SH na disulfidové můstky S-S, což vede k jejich denaturaci..
Stejně tak zastaví replikaci DNA reakcí s dusíkatými bázemi, ovlivňuje úplnou oxidaci glukózy a může také deformovat buněčnou membránu. Všechny tyto akce nakonec způsobí smrt bakterií.
Dezinfekce a čištění
Proto se řešení HClO nakonec používají k:
-Léčba infekčních ran a gangrény
-Dezinfikujte zásoby vody
-Sterilizační prostředek pro chirurgický materiál nebo nástroje používané ve veterinární medicíně, medicíně a zubním lékařství
-Dezinfekční prostředek na jakýkoli typ povrchu nebo předmětu obecně: tyče, zábradlí, kávovary, keramika, skleněné stoly, laboratorní pulty atd..
-Syntetizujte chloroaminy, které slouží jako méně agresivní antibiotika, ale zároveň odolnější, specifičtější a stabilnější než samotný HClO
Rizika
Roztoky HClO mohou být nebezpečné, pokud jsou vysoce koncentrované, protože mohou prudce reagovat s druhy náchylnými k oxidaci. Navíc mají tendenci uvolňovat plynný chlór, když jsou destabilizováni, takže musí být skladovány pod přísným bezpečnostním protokolem..
HClO je tak reaktivní vůči choroboplodným zárodkům, že tam, kde je napojena, okamžitě zmizí, aniž by později představovala riziko pro ty, kteří se dotýkají povrchů, které ošetřují. Totéž se děje uvnitř organismu: rychle se rozkládá nebo je neutralizován jakýmkoli druhem v biologickém prostředí.
Pokud je generován samotným tělem, je pravděpodobné, že může tolerovat nízké koncentrace HClO. Pokud je však vysoce koncentrovaný (používá se k syntetickým účelům a nikoli k dezinfekci), může mít nežádoucí účinky také tím, že napadne zdravé buňky (například kůže).
Reference
- Shiver & Atkins. (2008). Anorganická chemie. (Čtvrté vydání). Mc Graw Hill.
- Gottardi, W., Debabov, D., & Nagl, M. (2013). N-chloraminy, slibná třída dobře tolerovaných lokálních antiinfektiv. Antimikrobiální látky a chemoterapie, 57 (3), 1107-1114. doi: 10.1128 / AAC.02132-12
- Autor: Jeffrey Williams, Eric Rasmussen & Lori Robins. (06.10.2017). Kyselina chlorná: Využití vrozené reakce. Obnoveno z :infectioncontrol.tips
- Hydro Instruments. (s.f.). Základní chemie chlorace. Obnoveno z: hydroinstruments.com
- Wikipedia. (2019). Kyselina chlorná. Obnoveno z: en.wikipedia.org
- Serhan Sakarya a kol. (2014). Kyselina chlorná: Ideální prostředek pro ošetření ran s výkonnou mikrobicidní, antibakteriální a léčivou účinností. HMP rány. Obnoveno z: woundsresearch.com
- PrebChem. (2016). Příprava kyseliny chlorné. Obnoveno z: prepchem.com



Zatím žádné komentáře