
Vzorec kyseliny hypoxodinové (HIO), vlastnosti a použití

The kyselina hypojodová, také známý jako vodík monoxo jodičnan (I) nebo jodol, je to anorganická sloučenina vzorce HIO. Je to oxokyselina jodu s atomem kyslíku, atomem vodíku a atomem jodu s oxidačním stavem 1+.
Sloučenina je velmi nestabilní, protože má tendenci podstoupit dismutační reakci, při které se redukuje na molekulární jod a podle reakce se oxiduje na kyselinu jodovou: 5HIO → 2Idva + HIO3 + 2HdvaNEBO.
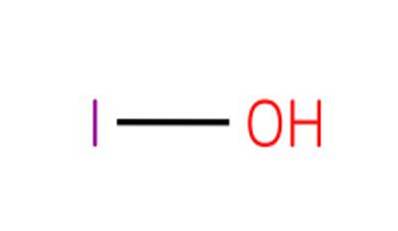
Tato sloučenina je nejslabší kyselinou z oxidačních stavů halogenových kyselin 1+. Odpovídající soli této kyseliny jsou známé jako hypojodity.
Tyto soli jsou stabilnější než kyseliny a vytvářejí se podobně jako jejich chlorové a bromové protějšky reakcí molekulárního jodu s hydroxidy alkalických kovů nebo kovů alkalických zemin..
Kyselina hypo-jodová se vyrábí reakcí molekulárního jodu s oxidem rtuťnatým (Egon Wiberg, 2001) podle reakce:
2Idva + 3HgO + HdvaO → 2HIO + HgIdva ● 2HgO
Stopy sloučeniny se také získají reakcí molekulárního jodu s hydroxidem draselným za vzniku jodidu draselného a hypojodičnanu draselného podle reakce:
Jádva + 2KOH → KI + KIO
Kyselina hypojodinová, která je tak slabou kyselinou, však umožňuje hydrolýzu hypojoditanu draselného, pokud není nadbytek hydroxidu draselného (Holmyard, 1922)..
KIO + HdvaO → HIO + KOH
Lze jej také získat, stejně jako jeho protějšky z chloru a bromu, reakcí molekulárního jodu s vodou. Vzhledem k jeho nízké rovnovážné konstantě, která je řádově 10-13, získaná množství jsou velmi malá (R.G. Compton, 1972).
Rejstřík článků
- 1 Fyzikální a chemické vlastnosti
- 2 Reaktivita a nebezpečí
- 3 použití
- 4 Odkazy
Fyzikální a chemické vlastnosti
Kyselina hypojodinová existuje pouze jako vodný roztok, který má nažloutlou barvu. Sloučenina v pevném stavu nebyla izolována, takže většina jejích vlastností je teoreticky získána výpočetními výpočty (National Center for Biotechnology Information, 2017).
Kyselina hypojodinová má molekulovou hmotnost 143,911 g / mol, teplotu tání 219,81 ° C, teplotu varu 544,27 ° C a tlak par 6,73 x 10-14 milimetry rtuti.
Molekula je velmi rozpustná ve vodě a je schopna se rozpouštět mezi 5,35 x 105 a 8,54 x 105 gramů sloučeniny na litr tohoto rozpouštědla (Royal Society of Chemistry, 2015).
HOI je silný oxidant a může vytvářet výbušné směsi. Je to také redukční činidlo a může být oxidováno na jodovou, jodovou a periodickou formu kyseliny. Ve vodných roztocích je slabá kyselina a částečně se disociuje na hypojoditový iont (OI-) a H+.
HOI reaguje s bázemi za vzniku solí nazývaných hypojodity. Například hypojodičnan sodný (NaOI) vzniká reakcí kyseliny jodovodíkové s hydroxidem sodným..
HOI + NaOH → NaOI + HdvaNEBO
Kyselina hypojodinová také snadno reaguje s řadou organických molekul a biomolekul..
Reaktivita a nebezpečí
Kyselina hypojodová je nestabilní sloučenina rozkládající se na elementární jód. Jód je toxická sloučenina, se kterou je třeba zacházet opatrně.
Kyselina hypojodová je nebezpečná při kontaktu s pokožkou (dráždivá), při kontaktu s očima (dráždivá) a při požití a vdechování.
V případě kontaktu s očima zkontrolujte, zda nosíte kontaktní čočky, a ihned je vyjměte. Oči by měly být proplachovány tekoucí vodou po dobu nejméně 15 minut, přičemž víčka udržujte otevřená. Lze použít studenou vodu. Oční mast by se neměla používat.
Pokud chemikálie přijde do styku s oděvem, co nejdříve ji odstraňte, abyste si chránili ruce a tělo. Umístěte postiženého pod bezpečnostní sprchu.
Pokud se chemikálie hromadí na exponované pokožce oběti, například na rukou, kontaminovaná kůže se jemně a opatrně omyje tekoucí vodou a neabrazivním mýdlem. Lze použít studenou vodu. Pokud podráždění přetrvává, vyhledejte lékařskou pomoc. Kontaminovaný oděv před dalším použitím vyperte.
Pokud je kontakt s pokožkou silný, měl by být omyt dezinfekčním mýdlem a kontaminovanou pokožku překrýt antibakteriálním krémem..
V případě vdechnutí by měl být postižený ponechán v klidu na dobře větraném místě. Pokud je vdechnutí těžké, měla by být oběť co nejdříve evakuována do bezpečného prostoru. Uvolněte těsné oblečení, jako je límeček, opasek nebo kravata.
Pokud postižený dýchá obtížně, měl by být podán kyslík. Pokud postižený nedýchá, provede se resuscitace z úst do úst. Vždy mějte na paměti, že pro osobu poskytující pomoc může být resuscitace z úst do úst nebezpečná, pokud je vdechovaný materiál toxický, infekční nebo žíravý..
Při požití nevyvolávejte zvracení. Uvolněte těsné oblečení, jako jsou límce košile, opasky nebo kravaty. Pokud oběť nedýchá, proveďte resuscitaci z úst do úst.
Ve všech případech okamžitě vyhledejte lékařskou pomoc..
Aplikace
Kyselina hypojodová se používá jako silné oxidační činidlo a jako redukční činidlo při laboratorních reakcích. Používá se k výrobě chemických sloučenin známých jako hypojodity..
Spektrofotometrické metody se také používají k měření tvorby kyseliny hypojodinové ke sledování reakcí, při nichž je zahrnut jód (T. L. Allen, 1955)..
Halogenidy jsou zabudovány do aerosolů, kde začínají katalytickou destrukci ozonu (O3) nad oceány a ovlivňují globální troposféru. Probíhajícím výzkumem jsou dva zajímavé problémy životního prostředí: porozumění tomu, jak se molekulární halogeny v reaktivní plynné fázi produkují přímo z anorganických halogenidů vystavených působení O3 a omezit faktory prostředí, které tento mezifázový proces řídí.
V práci (Elizabeth A. Pillar, 2013) byla konverze jodidu na kyselinu hypojodovou působením ozonu měřena pomocí měření hmotnostní spektroskopií za účelem stanovení modelu vyčerpání ozonu v atmosféře..
Reference
- Egon Wiberg, N. W. (2001). Anorganická chemie. London: Academic press.
- Elizabeth A. Pillar, M. I. (2013). Konverze jodidu na kyselinu chlorovodíkovou a jod ve vodních mikrokapkách vystavených ozónu. Sci. Technol., 47 (19), 10971-10979.
- EMBL-EBI. (2008, 5. ledna). kyselina jodovodíková. Citováno z ChEBI: ebi.ac.uk.
- Holmyard, E. (1922). Anorganická chemie. Londýn: Edwar Arnol & spol.
- Národní centrum pro biotechnologické informace… (2017, 22. dubna). Složená databáze PubChem; CID = 123340. Citováno z PubChem.
- G. Compton, C. B. (1972). Reakce nekovových anorganických sloučenin. Ansterdam: Elsevier Publishing Company.
- Royal Society of Chemistry. (2015). Jodol. Obnoveno z chemspider.com.
- L. Allen, R. M. (1955). Tvorba kyseliny jodovodíkové a hydratovaného jodového kationu hydrolýzou jódu. J. Am. Chem. Soc., 77 (11) , 2957-2960.


Zatím žádné komentáře