
Vlastnosti, struktura a použití kyseliny sírové (H2SO4)
The kyselina sírová (HdvaSW4) Je to kapalná, mastná a bezbarvá chemická sloučenina, rozpustná ve vodě s uvolňováním tepla a korozivní pro kovy a tkaniny. Při kontaktu s ním karbonizuje dřevo a většinu organických látek, ale je nepravděpodobné, že by způsobil požár.
Kyselina sírová je možná nejdůležitější ze všech těžkých průmyslových chemikálií a její spotřeba byla mnohokrát uváděna jako indikátor celkového stavu národní ekonomiky..

Dlouhodobé vystavení nízkým koncentracím nebo krátkodobé vystavení vysokým koncentracím může mít nepříznivé účinky na zdraví. Zdaleka nejdůležitější použití kyseliny sírové je v průmyslu fosfátových hnojiv.
Dalšími důležitými aplikacemi jsou rafinace ropy, výroba pigmentů, moření oceli, těžba neželezných kovů a výroba výbušnin, detergentů, plastů, umělých vláken a farmaceutik..
Rejstřík článků
- 1 Vitriol, předchůdce kyseliny sírové
- 2 Vzorec
- 3 Chemická struktura
- 3.1 Ve 2D
- 3.2 Ve 3D
- 4 Funkce
- 4.1 Fyzikální a chemické vlastnosti
- 4.2 Reakce se vzduchem a vodou
- 4.3 Hořlavost
- 4.4 Reaktivita
- 4.5 Toxicita
- 5 použití
- 5.1 Nepřímo
- 5.2 Přímé
- 6 Rozvoj průmyslu kyseliny sírové
- 6.1 Proces Vitriol
- 6.2 Olověné komory
- 7 Současná výroba: kontaktní proces
- 7.1 Proces dvojitého kontaktu
- 8 Suroviny používané při výrobě kyseliny sírové
- 8.1 Pyrit
- 8.2 Oxid siřičitý
- 8.3 Recyklovaný
- 9 Klinické účinky
- 10 Bezpečnost a rizika
- 10.1 Třídy nebezpečnosti GHS
- 10.2 Kódy bezpečnostních pokynů
- 11 Reference
Vitriol, předchůdce kyseliny sírové
Ve středověké Evropě byla kyselina sírová alchymisty známá jako vitriol, vitriolový olej nebo vitriolový likér. Byla považována za nejdůležitější chemickou látku a byla vyzkoušena jako kámen mudrců.
Sumerové již měli seznam různých druhů vitriolů. Galen, řecký lékař Dioscorides a Plinius starší také rozšířili své lékařské použití.

V helénistických alchymistických pracích již bylo zmíněno metalurgické použití vitriolických látek. Vitriol je skupina skelných minerálů, ze kterých lze získat kyselinu sírovou.
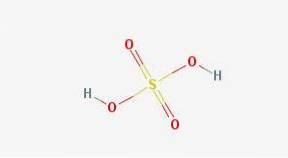
Vzorec
-Vzorec: HdvaSW4
-Číslo CAS: 7664-93-9
Chemická struktura
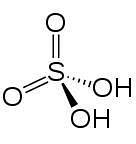
Ve 2D
Ve 3D
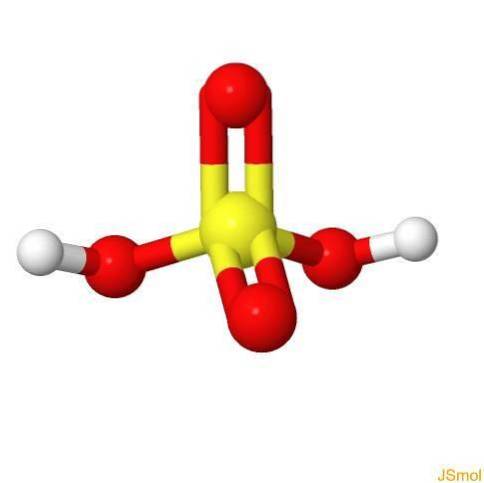
Vlastnosti
Fyzikální a chemické vlastnosti

Kyselina sírová patří do reaktivní skupiny silně oxidujících kyselin.
Reakce se vzduchem a vodou
- Reakce s vodou je zanedbatelná, pokud kyselost není vyšší než 80-90%, pak je hydrolýzní teplo extrémní, může způsobit těžké popáleniny.
Hořlavost
- Silné oxidační kyseliny jsou obecně nehořlavé. Mohou urychlit spalování jiných materiálů poskytnutím kyslíku do místa spalování.
- Kyselina sírová je však vysoce reaktivní a je schopná vznítit jemně rozptýlené hořlavé materiály při kontaktu s nimi..
- Při zahřátí vydává vysoce toxické výpary.
- Je výbušný nebo nekompatibilní s velkým množstvím látek.
- Může podléhat prudkým chemickým změnám při vysokých teplotách a tlaku.
- Může prudce reagovat s vodou.
Reaktivita
- Kyselina sírová je silně kyselá.
- Prudce reaguje s pentafluoridem bromitým.
- Exploduje para-nitrotoluenem při 80 ° C.
- Výbuch nastane, když je koncentrovaná kyselina sírová smíchána s krystalickým manganistanem draselným v nádobě, která obsahuje vlhkost. Vzniká heptoxid manganatý, který exploduje při 70 ° C.
- Směs akrylonitrilu s koncentrovanou kyselinou sírovou musí být dobře chlazena, jinak dojde k prudké exotermické reakci..
- Teplota a tlak se zvyšují, když se kyselina sírová (96%) smíchá ve stejných dávkách v uzavřené nádobě s některou z následujících látek: acetonitril, akrolein, 2-aminoethanol, hydroxid amonný (28%), anilin, n-butyraldehyd, chlorsulfonová kyselina kyselina, ethylen diamin, ethylenimin, epichlorhydrin, ethylenkyanohydrin, kyselina chlorovodíková (36%), kyselina fluorovodíková (48,7%), propylenoxid, hydroxid sodný, styrenový monomer.
- Kyselina sírová (koncentrovaná) je extrémně nebezpečná při kontaktu s karbidy, bromičnany, chlorečnany, primery, pikráty a práškovými kovy..
- Může vyvolat prudkou polymeraci allylchloridu a exotermicky reaguje s chlornanem sodným za vzniku plynného chloru.
- Smícháním kyseliny chlorsírové a 98% kyseliny sírové se získá HC1.
Toxicita
- Kyselina sírová je korozivní pro všechny tkáně v těle. Vdechování par může způsobit vážné poškození plic. Kontakt s očima může mít za následek úplnou ztrátu zraku. Kontakt s pokožkou může způsobit těžkou nekrózu.
- Polykání kyseliny sírové v množství mezi 1 čajovou lžičkou a půl unce koncentrované chemikálie může být pro dospělého smrtelné. Dokonce i několik kapek může být smrtelných, pokud se kyselina dostane do průdušnice.
- Chronická expozice může způsobit tracheobronchitidu, stomatitidu, konjunktivitidu a gastritidu. Může dojít k perforaci žaludku a peritonitidě, po které může následovat oběhový kolaps. Okamžitý šok je často bezprostřední příčinou smrti.
- Pacienti s chronickými respiračními, gastrointestinálními nebo nervovými chorobami a jakýmikoli očními a kožními chorobami jsou vystaveni zvýšenému riziku.
Aplikace
- Kyselina sírová je jednou z nejpoužívanějších průmyslových chemikálií na světě. Většinu jeho použití však lze považovat za nepřímé, protože se účastní spíše jako činidlo než jako přísada.
- Většina kyseliny sírové končí jako kyselina použitá při výrobě jiných sloučenin nebo jako nějaký druh síranového zbytku.
- Řada výrobků obsahuje síru nebo kyselinu sírovou, ale téměř všechny z nich jsou speciální výrobky malého objemu..
- Asi 19% kyseliny sírové vyrobené v roce 2014 bylo spotřebováno asi ve dvaceti chemických procesech a zbytek byl spotřebován v nejrůznějších průmyslových a technických aplikacích.
- Celosvětový růst poptávky po kyselině sírové je způsoben v sestupném pořadí produkcí: kyseliny fosforečné, oxidu titaničitého, kyseliny fluorovodíkové, síranu amonného a při zpracování uranu a metalurgických aplikacích.
Nepřímý
- Největším spotřebitelem kyseliny sírové je zdaleka průmysl hnojiv. V roce 2014 představoval něco málo přes 58% celkové světové spotřeby. Očekává se však, že tento podíl do roku 2019 poklesne na přibližně 56%, zejména v důsledku vyššího růstu v jiných chemických a průmyslových aplikacích..
- Výroba fosforečnanových hnojiv, zejména kyseliny fosforečné, je hlavním trhem s kyselinou sírovou. Používá se také k výrobě hnojivých materiálů, jako je trojitý superfosfát a mono a diamoniumfosfáty. Menší množství se používá k výrobě superfosfátu a síranu amonného.
- V jiných průmyslových aplikacích se podstatná množství kyseliny sírové používají jako kyselé dehydratační reakční médium, v organické chemii a petrochemických procesech zahrnujících reakce, jako je nitrace, kondenzace a dehydratace, stejně jako při rafinaci ropy. rafinace, alkylace a čištění surových destilátů.
- V anorganickém chemickém průmyslu je jeho použití pozoruhodné při výrobě pigmentů TiO2, kyseliny chlorovodíkové a kyseliny fluorovodíkové..
- V průmyslu zpracování kovů se kyselina sírová používá k moření oceli, k loužení měděných, uranových a vanadových rud při hydrometalurgickém zpracování minerálů a při přípravě elektrolytických lázní pro čištění a pokovování kovů. železný.
- Určité procesy výroby dřevoviny v papírenském průmyslu, při výrobě některých textilií, při výrobě chemických vláken a při vydělávání kůží také vyžadují kyselinu sírovou.
Přímo
- Pravděpodobně největší využití kyseliny sírové, ve které je síra zabudována do konečného produktu, je v procesu organické sulfonace, zejména při výrobě detergentů..
- Sulfonace také hraje důležitou roli při získávání dalších organických chemikálií a menších farmaceutik..
- Olověné baterie jsou jedním z nejznámějších spotřebních výrobků obsahujících kyselinu sírovou a představují pouze malý zlomek celkové spotřeby kyseliny sírové..
- Za určitých podmínek se kyselina sírová používá přímo v zemědělství k rehabilitaci vysoce zásaditých půd, jaké se nacházejí v pouštních oblastech západních Spojených států. Toto použití však není příliš důležité z hlediska celkového objemu použité kyseliny sírové..
Rozvoj průmyslu kyseliny sírové
Proces Vitriol

Nejstarší metodou získávání kyseliny sírové je takzvaný „proces vitriolu“, který je založen na tepelném rozkladu vitriolů, které jsou sulfáty různých typů, přírodního původu..
Perskí alchymisté, Jābir ibn Hayyān (také známý jako Geber, 721 - 815 nl), Razi (865 - 925 nl) a Jamal Din al-Watwat (1318 nl), zahrnuli vitriol do svých seznamů minerálních klasifikací.
První zmínka o „vitriolovém procesu“ se objevuje ve spisech Džabíra ibn Hayyana. Poté alchymisté sv. Albert Veliký a Basilius Valentinus popsali proces podrobněji. Jako suroviny byly použity kamenec a chalcanthit (modrý vitriol).
Na konci středověku byla kyselina sírová získávána v malém množství ve skleněných nádobách, ve kterých byla ve vlhkém prostředí spalována síra ledkem..
Proces vitriolu se v průmyslovém měřítku používal od 16. století kvůli větší poptávce po kyselině sírové.
Vitriol z Nordhausenu
Těžiště výroby bylo v německém městě Nordhausen (proto se vitriol začal nazývat „Nordhausen vitriol“), kde síran železitý (zelený vitriol, FeSO4 - 7HdvaO) jako surovina, která byla zahřátá a výsledný oxid sírový byl smíchán s vodou, čímž byla získána kyselina sírová (olej z vitriolu).
Proces byl prováděn na galérách, z nichž některé měly několik úrovní paralelně, aby se získalo větší množství vitriolového oleje..
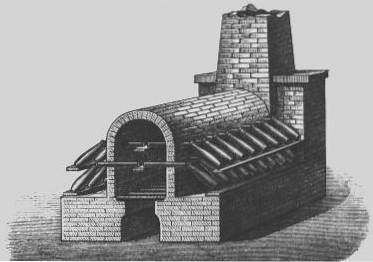
Olověné komory
V 18. století byl vyvinut ekonomičtější proces výroby kyseliny sírové známý jako „proces olověné komory“.
Do té doby byla maximální získaná koncentrace kyseliny 78%, zatímco u „vitriolového procesu“ byla získána koncentrovaná kyselina a oleum, takže se tato metoda nadále používala v určitých průmyslových odvětvích, dokud se neobjevil „proces kontaktu“. v roce 1870, s nímž lze levnější získat koncentrovanou kyselinu.
Oleum nebo dýmavá kyselina sírová (CAS: 8014-95-7) je roztok olejové konzistence a tmavě hnědé barvy s různým složením oxidu sírového a kyseliny sírové, který lze popsat vzorcem HdvaSW4.xSO3 (kde x představuje volný molární obsah oxidu siřičitého (VI)). Hodnota pro x 1 dává empirický vzorec HdvaSdvaNEBO7, odpovídající kyselině disulfurové (nebo kyselině pyrosulfurové).
Proces
Proces olověné komory byl průmyslovou metodou používanou k výrobě kyseliny sírové ve velkém množství, než byl nahrazen „kontaktním procesem“.
V roce 1746 v Birminghamu v Anglii začal John Roebuck vyrábět kyselinu sírovou v komorách vyložených olovem, které byly silnější a levnější než dříve používané skleněné nádoby a mohly být vyrobeny mnohem větší.
Oxid siřičitý (ze spalování elementární síry nebo kovových minerálů obsahujících síru, jako je pyrit) byl zaveden párou a oxidem dusíku do velkých komor vyložených olověnými plechy..
Oxid siřičitý a oxid dusičitý se rozpustily a po dobu přibližně 30 minut se oxid siřičitý oxidoval na kyselinu sírovou..
To umožnilo účinnou industrializaci výroby kyseliny sírové a s různými vylepšeními zůstal tento proces standardní metodou výroby téměř dvě století..
V roce 1793 dosáhli Clemente a Desormes lepších výsledků zavedením doplňkového vzduchu do procesu olověné komory..
V roce 1827 představil Gay-Lussac metodu absorpce oxidů dusíku z odpadních plynů olověné komory..
V roce 1859 Glover vyvinul metodu zpětného získávání oxidů dusíku z nově vytvořené kyseliny stripováním horkými plyny, což umožnilo kontinuální provádění katalytického procesu na oxidy dusíku..
V roce 1923 představil Petersen vylepšený věžový proces, který mu umožňoval konkurenceschopnost s kontaktním procesem až do padesátých let..
Komorový proces se stal tak robustním, že v roce 1946 stále představoval 25% světové produkce kyseliny sírové..
Současná výroba: kontaktní proces
Kontaktní proces je současný způsob výroby kyseliny sírové ve vysokých koncentracích, který je nezbytný v moderních průmyslových procesech. Platina bývala katalyzátorem této reakce. Nyní je však preferován oxid vanaditý (V2O5).
V roce 1831 patentoval Peregrine Phillips v anglickém Bristolu oxidaci oxidu siřičitého na oxid sírový pomocí platinového katalyzátoru při zvýšených teplotách..
Přijetí jeho vynálezu a intenzivní vývoj kontaktního procesu však začaly až poté, co od roku 1872 vzrostla poptávka po oleu pro výrobu barviv..
Dále byly prohledány lepší pevné katalyzátory a byla zkoumána chemie a termodynamika rovnováhy SO2 / SO3..
Proces kontaktu lze rozdělit do pěti fází:
- Kombinace síry a dioxygen (O2) za vzniku oxidu siřičitého.
- Čištění oxidu siřičitého v čisticí jednotce.
- Přidání přebytečného dioxygenu k oxidu siřičitému v přítomnosti katalyzátoru na bázi oxidu vanadičitého při teplotách 450 ° C a tlaku 1 až 2 atm.
- Vytvořený oxid sírový se přidá k kyselině sírové, čímž se získá oleum (kyselina disulfurová).
- Potom se do vody přidá oleum za vzniku kyseliny sírové, která je vysoce koncentrovaná..
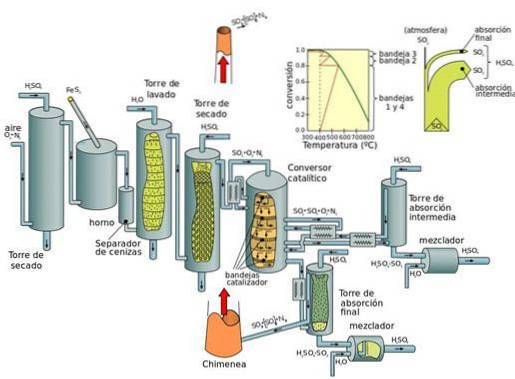
Základní nevýhodou procesů s oxidem dusíku (během procesu v hlavní komoře) je to, že koncentrace získané kyseliny sírové je omezena na maximálně 70 až 75%, zatímco kontaktní proces produkuje koncentrovanou kyselinu (98%).
S vývojem relativně levných katalyzátorů na bázi vanadu pro kontaktní proces, spolu s rostoucí poptávkou po koncentrované kyselině sírové, globální produkce kyseliny sírové v zařízeních na zpracování oxidu dusíku ustavičně klesala..
Do roku 1980 se v závodech na zpracování oxidů dusíku v západní Evropě a Severní Americe nevyráběla prakticky žádná kyselina.
Proces dvojitého kontaktu
Dvojitý kontakt s dvojitou absorpcí (DCDA nebo Double Contact Double Absorption) přinesl vylepšení kontaktního procesu pro výrobu kyseliny sírové.
V roce 1960 společnost Bayer požádala o patent na takzvaný proces dvojité katalýzy. První závod využívající tento proces byl zahájen v roce 1964.
Začleněním stupně absorpce SO3 Před závěrečnými katalytickými stupni umožnil vylepšený kontaktní proces výrazné zvýšení konverze SO.dva , podstatné snížení jeho emisí do atmosféry.
Plyny jsou vedeny zpět přes finální absorpční kolonu, čímž se získá nejen vysoký výkon přeměny SOdva na SO3 (přibližně 99,8%), ale také umožňující výrobu vyšší koncentrace kyseliny sírové.
Zásadní rozdíl mezi tímto procesem a běžným kontaktním procesem je v počtu absorpčních stupňů..
Od 70. let 20. století zavedly hlavní průmyslové země přísnější předpisy na ochranu životního prostředí a proces dvojitého převzetí se rozšířil v nových závodech. Konvenční kontaktní proces se však stále používá v mnoha rozvojových zemích s méně přísnými environmentálními normami..
Největší impuls pro současný vývoj kontaktního procesu je zaměřen na zvýšení využití a využití velkého množství energie vyrobené v tomto procesu..
Ve skutečnosti lze na moderní moderní závod na kyselinu sírovou pohlížet nejen jako na chemický závod, ale také jako na tepelnou elektrárnu..
Suroviny používané při výrobě kyseliny sírové
Pyrit
Pyrit byl dominantní surovinou při výrobě kyseliny sírové až do poloviny 20. století, kdy se velké množství elementární síry začalo získávat z procesu rafinace ropy a čištění zemního plynu a stalo se hlavní prémiovou surovinou pro průmysl.
Oxid siřičitý
V současné době se oxid siřičitý získává různými metodami z různých surovin.
Ve Spojených státech byl průmysl založen od prvních let 20. století na získávání elementární síry z podzemních ložisek „Fraschovým procesem“.
Středně koncentrovaná kyselina sírová se také vyrábí rekoncentrací a čištěním velkého množství kyseliny sírové získané jako vedlejší produkt jiných průmyslových procesů..
Recyklace
Recyklace této kyseliny je z hlediska životního prostředí stále důležitější, zejména v hlavních vyspělých zemích..
Výroba kyseliny sírové na bázi elementární síry a pyritu je samozřejmě relativně citlivá na tržní podmínky, protože kyselina vyrobená z těchto materiálů představuje primární produkt..
Naproti tomu, když je kyselina sírová vedlejším produktem vyráběným jako prostředek k odstraňování odpadu z jiného procesu, úroveň její výroby není dána podmínkami na trhu s kyselinou sírovou, ale tržními podmínkami pro primární produkt.
Klinické účinky
-Kyselina sírová se používá v průmyslu a v některých čisticích prostředcích pro domácnost, například v koupelnách. Používá se také v bateriích.
-Úmyslné požití, zejména vysoce koncentrovaných produktů, může způsobit vážná zranění a smrt. Tyto expozice požití jsou ve Spojených státech vzácné, ale převládají v jiných částech světa..
-Je to silná kyselina, která způsobuje poškození tkání a srážení bílkovin. Leptá pokožku, oči, nos, sliznice, dýchací cesty a zažívací trakt nebo jakoukoli tkáň, se kterou přichází do styku..
-Závažnost poranění je určena koncentrací a dobou kontaktu.
-Mírnější expozice (koncentrace nižší než 10%) způsobují pouze podráždění kůže, horních cest dýchacích a sliznice gastrointestinálního traktu.
-Dýchací účinky akutní expozice vdechováním zahrnují: podráždění nosu a krku, kašel, kýchání, reflexní bronchospazmus, dušnost a plicní edém. Smrt může nastat v důsledku náhlého kolapsu oběhu, otoku hlasivek a postižení dýchacích cest nebo akutního poranění plic.
-Požití kyseliny sírové může způsobit okamžitou bolest v nadbřišku, nevolnost, slinění a zvracení mukoidního nebo hemoragického materiálu, který vypadá jako „kávová sedlina“. Občas se objeví zvracení čerstvé krve.
-Požití koncentrované kyseliny sírové může vést ke korozi jícnu, nekróze a perforaci jícnu nebo žaludku, zejména v pyloru. Občas je vidět poranění tenkého střeva. Pozdější komplikace mohou zahrnovat stenózu a tvorbu píštěle. Po požití se může vyvinout metabolická acidóza.
-K těžkým popáleninám může dojít při nekróze a zjizvení. Mohou být smrtelné, pokud je zasažena dostatečně velká plocha povrchu těla..
-Oko je obzvláště citlivé na poškození korozí. Podráždění, slzení a zánět spojivek se mohou vyvinout i při nízkých koncentracích kyseliny sírové. Postříkání kyselinou sírovou ve vysokých koncentracích způsobuje: popáleniny rohovky, ztrátu zraku a příležitostně perforaci zeměkoule.
-Chronická expozice může být spojena se změnami plicních funkcí, chronickou bronchitidou, konjunktivitidou, emfyzémem, častými infekcemi dýchacích cest, gastritidou, erozí zubní skloviny a pravděpodobně rakovinou dýchacích cest..
Bezpečnost a rizika
Standardní věty o nebezpečnosti globálně harmonizovaného systému klasifikace a označování chemických látek (GHS)
Globálně harmonizovaný systém klasifikace a označování chemických látek (GHS) je mezinárodně schválený systém vytvořený Organizací spojených národů, jehož cílem je nahradit různé standardy klasifikace a označování používané v různých zemích pomocí konzistentních kritérií na globální úrovni (Nations United, 2015 ).
Třídy nebezpečnosti (a jejich odpovídající kapitola GHS), standardy klasifikace a označování a doporučení pro kyselinu sírovou jsou následující (Evropská chemická agentura, 2017; OSN, 2015; PubChem, 2017):
Třídy nebezpečnosti GHS
H303: Může být škodlivý při požití [Varování Akutní toxicita, orální - Kategorie 5] (PubChem, 2017).
H314: Způsobuje těžké poleptání kůže a poškození očí [Nebezpečí Žíravost / dráždivost pro kůži - Kategorie 1A, B, C] (PubChem, 2017).
H318: Způsobuje vážné poškození očí [Nebezpečí Vážné poškození očí / podráždění očí - Kategorie 1] (PubChem, 2017).
H330: Smrtelný při vdechování [Nebezpečí Akutní toxicita, vdechování - Kategorie 1, 2] (PubChem, 2017).
H370: Způsobuje poškození orgánů [Toxicita pro specifické cílové orgány - jednorázová expozice - Kategorie 1] (PubChem, 2017).
H372: Způsobuje poškození orgánů při prodloužené nebo opakované expozici [Nebezpečí Toxicita pro specifické cílové orgány - opakovaná expozice - Kategorie 1] (PubChem, 2017).
H402: Škodlivý pro vodní organismy [Nebezpečný pro vodní prostředí, akutní nebezpečí - Kategorie 3] (PubChem, 2017).
Kódy bezpečnostních pokynů
P260, P264, P270, P271, P273, P280, P284, P301 + P330 + P331, P303 + P361 + P353, P304 + P340, P305 + P351 + P338, P307 + P311, P310, P312, P314, P320, P321, P363, P403 + P233, P405 a P501 (PubChem, 2017).
Reference
- Arribas, H. (2012) Schéma výroby kyseliny sírové kontaktní metodou za použití pyritu jako suroviny [obrázek] Obnoveno z wikipedia.org.
- Příručka chemické ekonomiky, (2017). Kyselina sírová. Obnoveno z ihs.com.
- Příručka chemické ekonomiky (2017.) Světová spotřeba kyseliny sírové - 2013 [obrázek]. Obnoveno z ihs.com.
- ChemIDplus, (2017). 3D struktura 7664-93-9 - Kyselina sírová [obrázek] Obnoveno z: chem.nlm.nih.gov.
- Codici Ashburnhamiani (1166). Portrét „Gebera“ z 15. století. Knihovna Laurenziana Medicea [obrázek]. Obnoveno z wikipedia.org.
- Evropská agentura pro chemické látky (ECHA), (2017). Souhrn klasifikace a označení. Harmonizovaná klasifikace - příloha VI nařízení (ES) č. 1272/2008 (nařízení CLP).
- Databáze nebezpečných látek (HSDB). TOXNET. (2017). Kyselina sírová. Bethesda, MD, EU: National Library of Medicine. Obnoveno z: toxnet.nlm.nih.gov.
- Leyo (2007) Skeletální vzorec kyseliny sírové [obrázek]. Obnoveno z: commons.wikimedia.org.
- Liebig's Extract of Meat Company (1929) Albertus Magnus, Chimistes Celebres [obrázek]. Obnoveno z: wikipedia.org.
- Müller, H. (2000). Kyselina sírová a oxid sírový. V Ullmannově encyklopedii průmyslové chemie. Wiley-VCH Verlag GmbH & Co. KGaA. K dispozici na: doi.org.
- Organizace spojených národů (2015). Globálně harmonizovaný systém klasifikace a označování chemických látek (GHS), šesté přepracované vydání. New York, EU: Publikace OSN. Obnoveno z: unece.org.
- Národní centrum pro biotechnologické informace. Složená databáze PubChem, (2017). Kyselina sírová - struktura PubChem. [obrázek] Bethesda, MD, EU: National Library of Medicine. Obnoveno z: pubchem.ncbi.nlm.nih.gov.
- Národní centrum pro biotechnologické informace. Složená databáze PubChem, (2017). Kyselina sírová. Bethesda, MD, EU: National Library of Medicine. Obnoveno z: pubchem.ncbi.nlm.nih.gov.
- Národní úřad pro oceán a atmosféru (NOAA). CAMEO Chemicals. (2017). Chemický datový list. Kyselina sírová, spotřebovaná. Silver Spring, MD. EU; Obnoveno z: cameochemicals.noaa.gov.
- Národní úřad pro oceán a atmosféru (NOAA). CAMEO Chemicals. (2017). Chemický datový list. Kyselina sírová. Silver Spring, MD. EU; Obnoveno z: cameochemicals.noaa.gov.
- Národní úřad pro oceán a atmosféru (NOAA). CAMEO Chemicals. (2017). Datový list reaktivní skupiny. Kyseliny, silně oxidující. Silver Spring, MD. EU; Obnoveno z: cameochemicals.noaa.gov.
- Oelen, W. (2011) Kyselina sírová 96 procent extra čistá [obrázek]. Obnoveno z: wikipedia.org.
- Oppenheim, R. (1890). Schwefelsäurefabrik nach dem Bleikammerverfahren in der zweiten Hälfte des 19. Lehrbuch der Technischen Chemie [obrázek]. Obnoveno z: wikipedia.org.
- Priesner, C. (1982) Johann Christian Bernhardt und die Vitriolsäure, in: Chemie in unserer Zeit. [obrázek]. Obnoveno z: wikipedia.org.
- Stephanb (2006) Síran měďnatý [obrázek]. Obnoveno z: wikipedia.org.
- Stolz, D. (1614) Alchemical diagram. Theatrum Chymicum [obrázek] Obnoveno z: wikipedia.org.
- Wikipedia, (2017). Kyselina sírová. Obnoveno z: wikipedia.org.
- Wikipedia, (2017). Kyselina sírová. Obnoveno z: wikipedia.org.
- Wikipedia, (2017). Bleikammerverfahren. Obnoveno z: wikipedia.org.
- Wikipedia, (2017). Kontaktní proces. Obnoveno z: wikipedia.org.
- Wikipedia, (2017). Proces olověné komory. Obnoveno z: wikipedia.org.
- Wikipedia, (2017). Oleum. Obnoveno z: https://en.wikipedia.org/wiki/Oleum
- Wikipedia, (2017). Oleum. Obnoveno z: https://es.wikipedia.org/wiki/%C3%93leum
- Wikipedia, (2017). Oxid siřičitý Obnoveno z: wikipedia.org.
- Wikipedia, (2017). Proces Vitriol. Obnoveno z: wikipedia.org.
- Wikipedia, (2017). Oxid siřičitý. Obnoveno z: wikipedia.org.
- Wikipedia, (2017). Oxid siřičitý. Obnoveno z: wikipedia.org.
- Wikipedia, (2017). Kyselina sírová. Obnoveno z: wikipedia.org.
- Wikipedia, (2017). Vitriolverfahren. Obnoveno z: wikipedia.org.
- Wright, J. (1770) Alchymista, Hledání kamene mudrců, objevuje fosfor a modlí se za úspěšný závěr své operace, jak to bylo zvykem Ancient Chymical Astrologers. [obrázek] Obnoveno z: wikipedia.org.


Zatím žádné komentáře