
Vlastnosti a použití kyseliny jodové (HIO2)

The kyselina jodová Je to chemická sloučenina vzorce HIO2. Tato kyselina, stejně jako její soli (známé jako jodity), jsou extrémně nestabilní sloučeniny, které byly pozorovány, ale nikdy nebyly izolovány.
Je to slabá kyselina, což znamená, že nedisociuje úplně. V aniontu je jod v oxidačním stavu III a má strukturu analogickou s kyselinou chloritou nebo kyselinou bromitou, jak je znázorněno na obrázku 1.
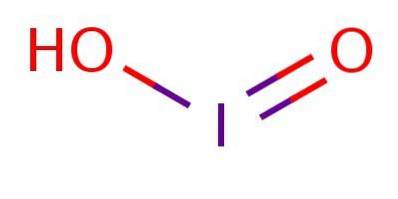
Přestože je sloučenina nestabilní, byla jodová kyselina a její jodičnanové soli detekovány jako meziprodukty při přeměně mezi jodidy (I-) a jodičnany (IO3-).
Jeho nestabilita je způsobena dismutační reakcí (nebo disproporcí) za vzniku kyseliny jodovodíkové a jodové, které jsou analogické s kyselinami chlorovodíkovými a bromičitými, a to následujícím způsobem:
2HIO2 -> HIO + HIO3
V Neapoli v roce 1823 napsal vědec Luigi Sementini dopis E. Daniellovi, tajemníkovi královské instituce v Londýně, kde vysvětlil způsob získávání kyseliny jodové.
V dopise uvedl, že vzhledem k tomu, že došlo k tvorbě kyseliny dusité, je kombinace kyseliny dusičné s tím, co nazýval plynný dusík (možná NdvaO), kyselina jodová mohla být vytvořena stejným způsobem reakcí kyseliny jodové s oxidem jodnatým, sloučeninou, kterou objevil.
Přitom získal žlutavě jantarovou kapalinu, která při kontaktu s atmosférou ztratila barvu (Sir David Brewster, 1902).
Později vědec M. Wöhler zjistil, že kyselina Sementini je směsí chloridu jodného a molekulárního jodu, protože oxid jodnatý použitý při reakci byl připraven s chlorečnanem draselným (Brande, 1828).
Rejstřík článků
- 1 Fyzikální a chemické vlastnosti
- 2 použití
- 2.1 Nukleofilní acylace
- 2.2 Dismutační reakce
- 2.3 Bray-Liebhafskyho reakce
- 3 Odkazy
Fyzikální a chemické vlastnosti
Jak již bylo zmíněno výše, kyselina jodová je nestabilní sloučenina, která nebyla izolována, takže její fyzikální a chemické vlastnosti jsou teoreticky získány výpočetními výpočty a simulacemi (Royal Society of Chemistry, 2015).
Kyselina jodová má molekulovou hmotnost 175,91 g / mol, hustotu 4,62 g / ml v pevném stavu, teplotu tání 110 stupňů Celsia (kyselina jodičná, 2013-2016).
Má také rozpustnost ve vodě 269 g / 100 ml při 20 stupních Celsia (což je slabá kyselina), má pKa 0,75 a má magnetickou susceptibilitu -48,0 · 10−6 cm3 / mol (Národní centrum pro biotechnologie Informace, sf).
Protože kyselina jodová je nestabilní sloučenina, která nebyla izolována, nehrozí s ní žádné zacházení. Teoretickými výpočty bylo zjištěno, že kyselina jodová není hořlavá..
Aplikace
Nukleofilní acylace
Jodová kyselina se používá jako nukleofil při nukleofilních acylačních reakcích. Příklad je uveden s acylací trifluoracetylů, jako je 2,2,2-trifluoracetylbromid, 2,2,2-trifluoracetylchlorid, 2,2,2-trifluoracetylfluorid a 2,2,2-trifluoracetyljodid za vzniku jodosylu 2,2,2 trifluoracetát, jak je znázorněno na obrázcích 2.1, 2.2, 2.3 a 2.4.

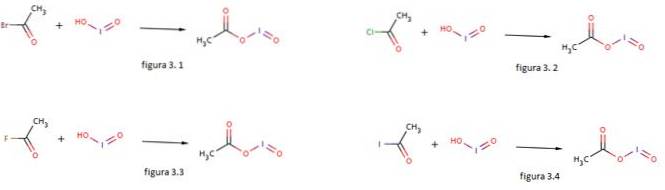
Jodová kyselina se také používá jako nukleofil pro tvorbu jodosylacetátu reakcí s acetylbromidem, acetylchloridem, acetylfluoridem a acetyljodidem, jak je znázorněno na obrázcích 3.1, 3.2, 3.3 a 3.4 (GNU Free Documentation, sf).
Dismutační reakce
Dismutační nebo disproporcionační reakce jsou typem oxidační redukční reakce, při které je oxidovaná látka stejná jako redukovaná.
V případě halogenů, které mají oxidační stavy -1, 1, 3, 5 a 7, lze v závislosti na použitých podmínkách získat různé produkty dismutačních reakcí..
V případě kyseliny jodové je příklad toho, jak reaguje za vzniku kyseliny hypojodové a kyseliny jodičné ve formě.
2HIO2 -> HIO + HIO3
Nedávné studie analyzovaly dismutační reakci kyseliny jodové měřením koncentrací protonů (H+), jodičnan (IO3-) a kyselý hypojoditový kation (HdvaIO+) za účelem lepšího porozumění mechanismu dismutace jodovou kyselinou (Smiljana Marković, 2015).
Byl připraven roztok obsahující meziprodukt I3+. Směs druhů jodu (I) a jodu (III) byla připravena rozpuštěním jodu (I.dva) a jodičnan draselný (KIO3), v poměru 1: 5, v koncentrované kyselině sírové (96%). V tomto řešení probíhá komplexní reakce, kterou lze popsat reakcí:
Jádva + 3IO3- + 8H+ -> 5IO+ + HdvaNEBO
Druh I.3+ jsou stabilní pouze za přítomnosti nadbytku jodičnanu. Jód brání tvorbě I3+. IO iont+ Získává se ve formě síranu jodnatého (IO) dvaSW4), se rychle rozkládá v kyselém vodném roztoku a tvoří I.3+, reprezentován jako kyselý HIOdva nebo iontový druh IO3-. Následně byla provedena spektroskopická analýza ke stanovení hodnoty koncentrací sledovaných iontů..
To představilo postup pro hodnocení pseudo-rovnovážných koncentrací vodíku, jodičnanu a iontů vodíku.dvaSLYŠEL JSEM+, Kinetické a katalytické druhy důležité v procesu disproporcionace kyseliny jodové, HIOdva.
Bray-Liebhafskyho reakce
Chemická hodinová nebo oscilační reakce je složitá směs reagujících chemických sloučenin, ve kterých se pravidelně mění koncentrace jedné nebo více složek nebo když po předvídatelné indukční době dojde k náhlým změnám vlastností..
Jedná se o třídu reakcí, které slouží jako příklad nerovnovážné termodynamiky, což vede k vytvoření nelineárního oscilátoru. Jsou teoreticky důležité, protože ukazují, že chemickým reakcím nemusí dominovat rovnovážné termodynamické chování..
Bray-Liebhafskyho reakce jsou chemické hodiny, které poprvé popsal William C. Bray v roce 1921, a jsou první oscilační reakcí v míchaném homogenním roztoku..
Jodová kyselina se experimentálně používá ke studiu tohoto typu reakcí, když se oxiduje peroxidem vodíku, čímž se dosáhne lepší shody mezi teoretickým modelem a experimentálními pozorováními (Ljiljana Kolar-Anić, 1992)..
Reference
- Brande, W. T. (1828). Manuál chemie na základě profesora Brandeho. Boston: University of Harvard.
- GNU bezplatná dokumentace. (s.f.). kyselina jodičná. Citováno z chemsink.com: chemsink.com
- kyselina jodičná. (2013-2016). Citováno z molbase.com: molbase.com
- Ljiljana Kolar-Anić, G. S. (1992). Mechanismus Bray-Liebhafského reakce: účinek oxidace kyseliny jodnaté peroxidem vodíku. Chem. Soc., Faraday Trans 1992,88, 2343-2349. http://pubs.rsc.org/en/content/articlelanding/1992/ft/ft9928802343#!divAbstract
- Národní centrum pro biotechnologické informace. (n.d.). Složená databáze PubChem; CID = 166623. Citováno z pubchem.com:pubchem.ncbi.nlm.nih.gov.
- Royal Society of Chemistry. (2015). Jodová kyselina ChemSpider ID145806. Citováno z ChemSpider: chemspider.com
- Sir David Brewster, R. T. (1902). The London and Edinburgh Philosophical Magazine and Journal of Science. londýn: londýnská univerzita.
- Smiljana Marković, R. K. (2015). Neproporcionální reakce kyseliny jodnaté, HOIO. Stanovení koncentrací příslušných iontových druhů H +, H2OI + a IO3 -.



Zatím žádné komentáře