
Kyselinové charakteristiky a příklady

The kyseliny jsou to sloučeniny s vysokou tendencí darovat protony nebo přijímat pár elektronů. Existuje mnoho definic (Bronsted, Arrhenius, Lewis), které charakterizují vlastnosti kyselin, a každá z nich je doplněna k vytvoření globálního obrazu tohoto typu sloučenin..
Z výše uvedeného pohledu mohou být všechny známé látky kyselé, avšak za takové se považují pouze ty, které vynikají daleko nad ostatní. Jinými slovy: pokud je látka extrémně slabým donorem protonu, například ve srovnání s vodou lze říci, že nejde o kyselinu.

V tomto případě, co přesně jsou kyseliny a jejich přírodní zdroje? Typický příklad z nich lze nalézt uvnitř mnoha druhů ovoce: například citrusů. Limonády mají svou charakteristickou chuť díky kyselině citronové a dalším složkám.
Jazyk dokáže detekovat přítomnost kyselin, stejně jako u jiných příchutí. V závislosti na úrovni kyselosti těchto sloučenin se chuť stává nesnesitelnější. Tímto způsobem jazyk funguje jako organoleptický měřič koncentrace kyselin, konkrétně koncentrace hydroniového iontu (H3NEBO+).
Na druhou stranu se kyseliny nenacházejí pouze v potravinách, ale také v živých organismech. Půdy rovněž představují látky, které je mohou charakterizovat jako kyselé; to je případ kationtů hliníku a jiných kovů.
Rejstřík článků
- 1 Charakteristika kyselin
- 1.1 - Fyzikální vlastnosti
- 1.2 - Schopnost generovat protony
- 1.3 - Mají vodíky chudé na hustotu elektronů
- 1.4 - Konstanta síly nebo kyselosti
- 1.5 - Má velmi stabilní konjugované báze
- 1.6 - Mohou mít kladné náboje
- 1.7 - Vaše roztoky mají hodnoty pH nižší než 7
- 1.8 - Schopnost neutralizovat báze
- 2 Silné a slabé kyseliny
- 3 Příklady kyselin
- 3.1 Halogenidy vodíku
- 3.2 Oxokyseliny
- 3.3 Super kyseliny
- 3.4 Organické kyseliny
- 4 Odkazy
Vlastnosti kyselin
Jaké vlastnosti musí mít sloučenina podle stávajících definic, aby mohla být považována za kyselou??
Musí být schopen generovat ionty H+ a OH- když se rozpouští ve vodě (Arrhenius), musí velmi snadno darovat protony jiným druhům (Bronsted), nebo nakonec musí být schopen přijmout pár elektronů a negativně se nabít (Lewis).
Tyto vlastnosti však úzce souvisí s chemickou strukturou. Naučíte-li se jej tedy analyzovat, je možné odvodit jeho sílu kyselosti nebo několika sloučenin, která z nich je nejkyselejší..
- Fyzikální vlastnosti
Kyseliny mají příchuť, která stojí za nadbytečnost, kyselinu a jejich vůně často pálí nosní dírky. Jsou to kapaliny s lepkavou nebo mastnou strukturou a mají schopnost měnit barvu lakmusového papíru a methyloranžové na červenou (Vlastnosti kyselin a zásad, S.F.).
- Schopnost generovat protony
V roce 1923 dánský chemik Johannes Nicolaus Brønsted a anglický chemik Thomas Martin Lowry představili teorii Brønsted a Lowry s tím, že jakákoli sloučenina, která může přenášet proton na jakoukoli jinou sloučeninu, je kyselina (Encyclopædia Britannica, 1998). Například v případě kyseliny chlorovodíkové:
HCl → H+ + Cl-
Brønsted a Lowryho teorie nevysvětlili kyselé chování určitých látek. V roce 1923 představil americký chemik Gilbert N. Lewis svou teorii, ve které se za kyselinu považuje jakákoli sloučenina, která je při chemické reakci schopná se spojit s párem elektronů nesdílených v jiné molekule (Encyclopædia Britannica, 1998).
Tímto způsobem ionty, jako je Cudva+, víradva+ a víra3+ Mají schopnost vázat se s páry volných elektronů, například z vody za vzniku protonů způsobem:
Cudva+ + 2HdvaO → Cu (OH)dva + 2H+
- Mají vodíky chudé na hustotu elektronů
Pro molekulu metanu CH4, žádný z jeho vodíků není elektronicky nedostatečný. Je to proto, že rozdíl elektronegativity mezi uhlíkem a vodíkem je velmi malý. Pokud by však jeden z atomů H byl nahrazen jedním z fluoru, pak by došlo k znatelné změně dipólového momentu: HdvaFC-H.
H zažívá posunutí svého elektronového mraku směrem k sousednímu atomu navázanému na F, což je stejné, δ + se zvyšuje. Opět platí, že pokud je jiný H nahrazen jiným F, pak by molekula vypadala jako: HFdvaC-H.
Nyní je δ + ještě vyšší, protože se jedná o dva vysoce elektronegativní atomy F, které odečítají elektronovou hustotu od C, a ten následně od C H. Pokud by proces substituce pokračoval, nakonec by byl získán: F3C-H.
V této poslední molekule H představuje v důsledku tří sousedních atomů F značný elektronický nedostatek. Toto δ + nezůstane bez povšimnutí žádným druhem dostatečně bohatým na elektrony, aby to zbavil H a tedy F3CH budou záporně účtovány:
F3C-H + : N- (negativní druh) => F3C:- + HN
Výše uvedenou chemickou rovnici lze také uvažovat takto: F3CH daruje proton (H.+, the H jakmile se oddělí od molekuly) a: N; o, F3CH získá pár elektronů H jako další pár byl darován druhému od: N-.
- Kyselost nebo konstantní
Kolik F3C:- je přítomna v řešení? Nebo kolik molekul F3CH může darovat kyselinu vodík N? K zodpovězení těchto otázek je nutné určit koncentraci F3C:- nebo z HN a pomocí matematické rovnice stanovte číselnou hodnotu zvanou konstanta kyselosti Ka.
Čím více molekul F3C:- nebo HN, tím více kyseliny bude F3CH a větší jeho Ka. Tímto způsobem pomáhá Ka kvantitativně objasnit, které sloučeniny jsou kyselější než jiné; a podobně se zbavuje kyselin těch, jejichž Ka jsou extrémně malého řádu.
Některé Ka mohou mít hodnoty kolem 10-1 a 10-5, a další, hodnoty miliontin menší než 10-patnáct a 10-35. Potom lze říci, že posledně uvedené, které mají uvedené konstanty kyselosti, jsou extrémně slabé kyseliny a mohou se jako takové zlikvidovat..
Která z následujících molekul má tedy nejvyšší Ka: CH4, CH3F, CHdvaFdva nebo CHF3? Odpověď spočívá v nedostatku elektronové hustoty, δ +, v jejich vodících..
Měření
Jaká jsou však kritéria pro standardizaci měření Ka? Jeho hodnota se může enormně lišit v závislosti na tom, který druh dostane H+. Například pokud: N je silná báze, Ka bude velká; ale pokud je to naopak velmi slabá základna, Ka bude malá.
Měření Ka se provádí pomocí nejběžnější a nejslabší ze všech zásad (a kyselin): vody. V závislosti na míře darování H+ na molekuly H.dvaNebo při 25 ° C a při tlaku jedné atmosféry jsou stanoveny standardní podmínky pro stanovení konstant kyselosti pro všechny sloučeniny.
Z toho vyplývá repertoár tabulek konstant kyselosti pro mnoho sloučenin, anorganických i organických..
- Má velmi stabilní konjugované báze
Kyseliny mají ve svých chemických strukturách vysoce elektronegativní atomy nebo jednotky (aromatické kruhy), které přitahují elektronové hustoty z okolních vodíků, což způsobuje, že jsou částečně pozitivní a reagují na bázi.
Jakmile se protony darují, kyselina se změní na konjugovanou bázi; tj. negativní druh schopný přijmout H+ nebo darovat pár elektronů. V příkladu molekuly CF.3H jeho konjugovaná báze je CF3-:
CF3- + HN <=> CHF3 + : N-
Ano, CF3- je velmi stabilní báze konjugátu, rovnováha bude posunuta více doleva než doprava. Čím stabilnější je, tím reaktivnější a kyselější bude kyselina..
Jak víte, jak jsou stabilní? Vše záleží na tom, jak se vypořádají s novým záporným nábojem. Pokud jej mohou delokalizovat nebo efektivně rozptýlit rostoucí elektronovou hustotu, nebude k dispozici pro použití při vazbě se základnou H..
- Mohou mít kladné náboje
Ne všechny kyseliny mají vodík s nedostatkem elektronů, ale mohou mít i jiné atomy schopné přijímat elektrony, s kladným nábojem nebo bez něj..
Jak je to? Například v fluoridu boritém, BF3, atomu B chybí oktet valence, takže může tvořit vazbu s jakýmkoli atomem, který mu dává pár elektronů. Pokud anion F- v jeho blízkosti dojde k následující chemické reakci:
BF3 + F- => BF4-
Na druhou stranu, volné kovové kationty, jako je Al3+, Zndva+, Na+, atd., jsou považovány za kyselé, protože ze svého prostředí mohou přijímat dativní (koordinační) vazby druhů bohatých na elektrony. Reagují také s OH ionty- vysrážet jako hydroxidy kovů:
Zndva+(aq) + 2OH-(ac) => Zn (OH)dva(s)
Všechny tyto látky jsou známé jako Lewisovy kyseliny, zatímco ty, které darují protony, jsou Bronstedovy kyseliny..
- Jejich roztoky mají hodnoty pH nižší než 7
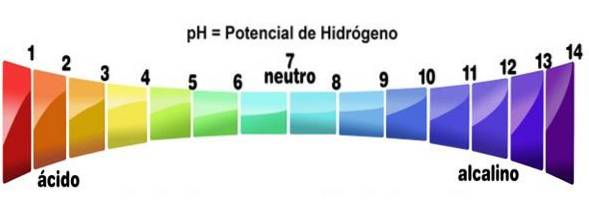
Přesněji řečeno, když se kyselina rozpustí v jakémkoli rozpouštědle (které ji znatelně neutralizuje), vytváří roztoky s pH nižším než 3, ačkoli pod 7 jsou považovány za velmi slabé kyseliny..
To lze ověřit pomocí acidobazického indikátoru, jako je fenolftalein, univerzální indikátor nebo fialová zelná šťáva. S těmi sloučeninami, které mění barvy na barvy indikované pro nízké pH, se zachází jako s kyselinami. Jedná se o jeden z nejjednodušších testů k určení jejich přítomnosti..
Totéž lze provést například pro různé vzorky půdy z různých částí světa, čímž se stanoví jejich hodnoty pH, které je spolu s dalšími proměnnými charakterizují..
A konečně, všechny kyseliny mají kyselé příchutě, pokud nejsou tak koncentrované, aby nenávratně spálily tkáně jazyka..
- Schopnost neutralizovat báze
Arrhenius ve své teorii navrhuje, aby kyseliny tím, že jsou schopné generovat protony, reagovaly s hydroxylem bází za vzniku soli a vody následujícím způsobem:
HCl + NaOH → NaCl + HdvaNEBO.
Tato reakce se nazývá neutralizace a je základem analytické techniky zvané titrace (Bruce Mahan, 1990)..
Silné a slabé kyseliny
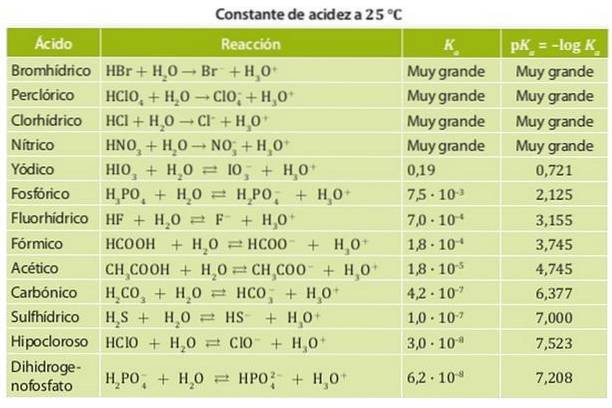
Kyseliny se dělí na silné kyseliny a slabé kyseliny. Síla kyseliny je spojena s její rovnovážnou konstantou, proto se v případě kyselin tyto konstanty nazývají konstanty kyselosti Ka.
Silné kyseliny tedy mají velkou kyselinovou konstantu, takže mají tendenci se úplně disociovat. Příkladem těchto kyselin je kyselina sírová, kyselina chlorovodíková a kyselina dusičná, jejichž kyselé konstanty jsou tak velké, že je nelze měřit ve vodě..
Na druhou stranu je slabá kyselina ta, jejíž disociační konstanta je nízká, takže je v chemické rovnováze. Příklady těchto kyselin jsou kyselina octová a kyselina mléčná a kyselina dusitá, jejichž konstanty kyselosti jsou řádově 10-4. Obrázek 1 ukazuje různé konstanty kyselosti pro různé kyseliny.
Příklady kyselin
Halogenovodíky
Všechny halogenovodíky jsou kyselé sloučeniny, zvláště jsou-li rozpuštěny ve vodě:
-HF (kyselina fluorovodíková).
-HCl (kyselina chlorovodíková).
-HBr (kyselina bromovodíková).
-HI (kyselina jodičná).
Oxokyseliny
Oxokyseliny jsou protonované formy oxoaniontů:
HNO3 (kyselina dusičná).
HdvaSW4 (kyselina sírová).
H3PO4 (kyselina fosforečná).
HClO4 (kyselina chloristá).
Super kyseliny
Superkyseliny jsou směsí silné Bronstedovy kyseliny a silné Lewisovy kyseliny. Po smíchání tvoří složité struktury, kde podle určitých studií H+ „Skoč“ do nich.
Jejich korozivní síla je taková, že jsou miliardkrát silnější než HdvaSW4 koncentrovaný. Používají se k štěpení velkých molekul přítomných v ropě na menší rozvětvené molekuly as velkou přidanou ekonomickou hodnotou..
-BF3/ HF
-SbF5/ HF
-SbF5/ HSO3F
-CF3SW3H
Organické kyseliny
Organické kyseliny se vyznačují tím, že mají jednu nebo více karboxylových skupin (COOH) a mezi nimi jsou:
-Kyselina citronová (přítomná v mnoha druzích ovoce)
-Kyselina jablečná (ze zelených jablek)
-Kyselina octová (z obchodního octa)
-Kyselina máselná (z žluklého másla)
-Kyselina vinná (z vín)
-A rodina mastných kyselin.
Reference
- Torrens H. Tvrdé a měkké kyseliny a zásady. [PDF]. Převzato z: depa.fquim.unam.mx
- Helmenstine, Anne Marie, Ph.D. (3. května 2018). Názvy 10 běžných kyselin. Obnoveno z: thoughtco.com
- Chempages Netorials. Kyseliny a zásady: Molekulární struktura a chování. Převzato z: chem.wisc.edu
- Deziel, Chris. (27. dubna 2018). Obecné charakteristiky kyselin a zásad. Vědění. Obnoveno z: sciencing.com
- Pittsburghské superpočítačové centrum (PSC). (25. října 2000). Obnoveno z: psc.edu.


Zatím žádné komentáře