
Struktura chloridu sodného (NaCl), vlastnosti, použití
The chlorid sodný, Také se nazývá kuchyňská sůl nebo kuchyňská sůl, jedná se o binární anorganickou sůl sodíku alkalického kovu a halogenového chloru. Je to největší složka jedlé soli a její minerální forma je známá jako halit. Jeho molekulární vzorec je NaCl a popisuje stechiometrický poměr jeho iontů (Na+ Cl-) a nikoli diskrétní molekuly (Na-Cl)
Chlorid sodný je bílá krystalická pevná látka, která je tvořena kombinací sodíku, stříbřitě bílého kovu, který prudce reaguje s vodou, a prvku chlor, jedovatého, leptavého a světle zeleného plynu..

Část krystalů NaCl je zobrazena na horním obrázku. Jak je možné, že dva prvky jsou stejně nebezpečné jako Na a Cldva, může se tvořit jedlá sůl? Za prvé, chemická rovnice pro jeho vznik je:
2Na (s) + Cldva(g) => 2NaCl (s)
Odpověď spočívá v povaze vazby v NaCl. Být iontový, vlastnosti Na+ a Cl- jsou úhlopříčně odlišné od jejich neutrálních atomů.
Sodík je životně důležitým prvkem, ale ve své iontové formě. Pak+ je hlavní extracelulární kation s koncentrací přibližně 140 mEq / l a spolu s jeho doprovodnými anionty, Cl- a HCO3- (hydrogenuhličitan), jsou zodpovědné hlavně za hodnotu osmolarity a extracelulárního objemu.
Dále Na+ je zodpovědný za tvorbu a vedení nervového impulsu v neuronových axonech, stejně jako za zahájení svalové kontrakce.
NaCl se používá od starověku k dochucování potravin a konzervování masa díky své schopnosti zabíjet bakterie a bránit znehodnocení.
Je také nezbytný pro výrobu hydroxidu sodného (NaOH) a molekulárního chloru (Cldva), reagující NaCl s vodou při hydrolýze:
2HdvaO (1) + 2 NaCl (s) => 2NaOH (vodný) + Cldva(g) + Hdva(G)
V katodě (-) se hromadí Hdva (g) a NaOH. Mezitím se v anodě (+) hromadí Cldva (G). Hydroxid sodný se používá při výrobě mýdel a chloru při výrobě plastů z PVC.
Rejstřík článků
- 1 Struktura chloridu sodného
- 1.1 Jednotková buňka
- 2 Vlastnosti
- 2.1 Molekulární vzorec
- 2.2 Molekulová hmotnost
- 2.3 Fyzický popis
- 2.4 Barva
- 2.5 Příchuť
- 2.6 Bod varu
- 2.7 Teplota tání
- 2.8 Rozpustnost ve vodě
- 2.9 Rozpustnost v organických rozpouštědlech
- 2.10 Hustota
- 2.11 Tlak par
- 2.12 Stabilita
- 2.13 Rozklad
- 2.14 Viskozita
- 2.15 Koroze
- 2,16 pH
- 3 použití
- 3.1 V potravinách
- 3.2 Průmyslové použití
- 3.3 Doma
- 3.4 Jiná použití
- 3.5 Terapeutické použití
- 4 Toxicita
- 4.1 Požití
- 4.2 Podráždění a fyzický kontakt
- 5 Reference
Struktura chloridu sodného
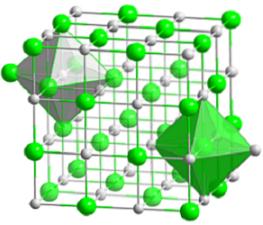
Horní obrázek představuje kompaktní kubickou strukturu chloridu sodného. Objemné zelené koule odpovídají aniontům Cl-, zatímco bílé, na kationty Na+. Všimněte si, jak se krystal NaCl skládá ze sítě iontů uspořádaných podle jejich elektrostatických interakcí v poměru 1: 1..
Ačkoli jsou na obrázku zobrazeny pruhy, vazby nejsou kovalentní, ale iontové. Použití sloupců je užitečné při zobrazování koordinační geometrie kolem iontu. Například v případě NaCl každý Na+ je obklopen šesti Cl- (bílý osmistěn) a každý Cl- šesti Na+ (zelený osmistěn).
Proto má koordinaci (6,6), jejíž čísla udávají, kolik sousedů obklopuje každý iont. Číslo vpravo označuje sousedy Na+, zatímco ten nalevo, ti z Cl-.
Ostatní reprezentace vynechávají použití pruhů ke zvýraznění oktaedrických děr ve struktuře, které jsou výsledkem intersticiálního prostoru mezi šesti Cl anionty.- (nebo Na kationty+) zabaleno. Toto uspořádání je pozorováno u jiných mono (MX) nebo polyatomových anorganických solí a nazývá se drahokamová sůl.
Jednotková buňka
Jednotková buňka kamenné soli je kubická, ale které kostky ji přesně znázorňují na obrázku výše? Odpověď dávají oktaedry. Oba pokrývají celkovou buňku složenou ze čtyř malých kostek.
Tyto kostky mají části iontů na jejich vrcholech, okrajích a plochách. Podíváme-li se zblízka, iont Na+ nachází se uprostřed a dvanáct z nich na okrajích. Ion na hraně může sdílet čtyři kostky. Existují tedy 4 ionty Na+ (12 × 1/4 + 1 = 4).
Pro ionty Cl-, osm je umístěno na vrcholech a šest na okrajích. Protože ionty umístěné na vrcholech sdílejí prostor s osmi dalšími kostkami a na okrajích se šesti máme 4 ionty Cl- (8 × 1/8 + 6 × 1/2 = 4).
Výše uvedený výsledek je interpretován následovně: v jednotkové buňce NaCl jsou čtyři Na kationty+ a čtyři Cl anionty-; podíl, který souhlasí s chemickým vzorcem (a Na+ pro každou Cl-).
Vlastnosti
Molekulární vzorec
NaCl.
Molekulární váha
58,44 g / mol.
Fyzický popis
Krystalická pevná látka.
Barva
Průhledné bezbarvé krystaly nebo bílý krystalický prášek.
Chuť
Slaný.
Bod varu
2 575 ° F až 760 mmHg.
1 465 ° C.
Bod tání
1 474 ° F (800,7 ° C).
Teplota varu i teplota tání odrážejí teplo nezbytné k překonání krystalické mřížkové energie. Tato měření proto potvrzují iontový charakter NaCl..
Rozpustnost ve vodě
Větší nebo rovno 100 mg / ml při 68 ° F.
36,0 g / 100 ml při 25 ° C.
Je to ve skutečnosti hygroskopická sůl, která zadržuje vlhkost z prostředí.
Rozpustnost v organických rozpouštědlech
0,065 g / 100 ml ethanolu při 25 ° C; 10 g / 100 g glycerolu při 25 ° C; 2,15 g / 100 ml kapalného amoniaku při 40 ° C; 1,4 g / 100 ml methanolu při 25 ° C; 7,15 g / 100 ethylenglykolu při 25 ° C a 5,21 g / 100 g kyseliny mravenčí při 25 ° C.
Hustota
2,165 g / cm3 při 77 ° C.
Tlak páry
1 mmHg při 1589 ° F.
Stabilita
Stabilní za doporučených skladovacích podmínek.
Rozklad
Při zahřátí na vysokou teplotu se rozkládá a uvolňuje kyselinu chlorovodíkovou a páry oxidu sodného..
Viskozita
Viskozita nasycených roztoků 1,93 mPa-s.
Koroze
Je korozivní pro mnoho kovů.
pH
6,7 až 7,3 ve vodném roztoku.
Aplikace
V jídle
-Chlorid sodný se od starověku používá ke zlepšení chuti jídla ak jeho uchování. Solení masa je způsob, jak jej chránit před bakteriálními účinky, protože zpomaluje rozklad bílkovin.
-Na druhou stranu sůl zvyšuje osmolaritu kolem masa, což způsobuje absorpci vody bakterií pomocí osmózy, což způsobuje její eliminaci.
Průmyslové použití
Potravinářský průmysl
-V potravinářském průmyslu se sůl používá jako zvýrazňovač chuti, přísada pro řízení fermentace, látka pro regulaci textury a vývojka barev. Například se přidává sůl, aby se zvýraznila barva ve slanině, šunce a dalších masných výrobcích..
-Sůl slouží jako pojivo při výrobě klobás. Přispívá k tvorbě pojivového gelu složeného z masa, tuku a vlhkosti.
-Při zpracování mouky na výrobu chleba se během pečení přidává sůl, která reguluje rychlost kynutí těsta. Používá se také k posílení lepku a jako látka zvýrazňující chuť a také jako náplň do pečiva.
-Používá se při výrobě snídaňových cereálií, smíšených nebo připravených mouček, hranolků, krmiv pro psy a kočky atd..
Syntéza chemických látek
-Chlorid sodný se používá jako surovina při výrobě hydroxidu sodného a chloru, což je zase užitečné v mnoha chemických průmyslových odvětvích.
-Sůl se používá při zpracování různých kovů, například hliníku, mědi, oceli a vanadu. Používá se také k výrobě chlorečnanu sodného, který se později používá při syntéze oxidu chloričitého, bělidla na bázi kyslíku. Oxid chloričitý je pro životní prostředí méně škodlivý než jiná bělidla.
V kožedělném průmyslu
-Sůl se používá k inhibici bakteriálního působení uvnitř pokožky a také na pomoc při její rehydrataci.
V textilním průmyslu
-Sůl se používá jako mořidlo při barvení tkanin. Používá se jako oplach solanky k odstranění organických nečistot a k vytvoření pozitivního náboje na povrchu tkanin, který umožňuje lepení negativně nabitých barviv.
V ropném průmyslu
-Při průzkumu ropy a zemního plynu je sůl důležitou součástí kapalin pro vrtání studní. Používá se k vyvločkování a zvýšení hustoty vrtných kapalin, což umožňuje překonat vysoké tlaky plynu v jamkách, kterých má být dosaženo. Kromě toho sůl udržuje nasycení vrtné kapaliny.
-Sůl pomáhá zhutňovat půdu, na které jsou postaveny silnice. Snižuje přemístění pod zemí způsobené změnami vlhkosti a automobilovým provozem.
Doma
Sůl byla používána třením na čištění povrchů, hrnců a pánví. Také v prevenci plísní a jako odstraňovač skvrn. Používá se také v mnoha značkách šamponů a zubních past..
Jiná použití
Na silnicích
-V očekávání sněžení jsou silnice pokryty solankou, která brání ulpívání ledu na povrchu vozovky. K rozmrazování se používá směs solanky a soli a někdy se přidávají další chemické složky, jako je chlorid hořečnatý nebo chlorid vápenatý. Použití solí a solného roztoku není účinné při teplotách pod -10 ° C.
Přidáním soli dojde ke snížení kryoskopického bodu, kogrativní vlastnosti roztoků, čímž určitým způsobem znemožníte tvorbu ledu..
-Díky svému hygroskopickému stavu se sůl používá jako levné vysoušedlo.
V pryskyřicích používaných ke změkčení vody
Tvrdá voda obsahuje ionty vápníku a hořčíku, které brání působení mýdla a způsobují usazeniny alkalických materiálů na různých zařízeních a potrubích. Při změkčování vody se používají iontoměničové pryskyřice. Sůl se používá při přípravě a regeneraci pryskyřic.
V hasicích přístrojích
Chlorid sodný se používá v hasicích přístrojích k hašení požárů, v nichž jsou přítomny hořlavé kovy, jako je hořčík, draslík, sodík a slitiny NK..
Sůl působí jako chladič a také tvoří kůru, která omezuje přístup kyslíku k ohni..
V brýlích
Krystaly chloridu sodného se používají v optických součástech, jako jsou okna a hranoly, zejména pro infračervené světlo. Jelikož je však sůl velmi hygroskopická, vytváří se druh mrazu, který zakrývá čočky. Z tohoto důvodu byly čočky s chloridem sodným nahrazeny čočkami selenidem zinečnatým (ZnSe)..
Terapeutické použití
Vyrovnejte nedostatek solí v těle
-Když dojde k tělesnému vyčerpání Na+, musí být nahrazeny, aby byla zachována extracelulární osmolarita, nervové vedení a svalová kontrakce.
-NaCl se používá k léčbě a prevenci nedostatku sodíku a chloru v důsledku nadměrného pocení během vystavení vysokým teplotám. Používá se také při nadměrné diuréze nebo nadměrném omezení příjmu solného roztoku.
-Při léčbě hyperosmolárního diabetu se používá parenterální dodávka 045% roztoku NaCl. Plní rehydratační funkci a slouží k hodnocení stavu funkce ledvin.
-Injekce hypertonických roztoků s koncentrací NaCl vyšší než 0,9% hmotn./obj,
-Používají se při silném vyčerpání Na+, obnova esenciálního iontu. Tato hyponatrémie může být důsledkem léčby volnými elektrolyty nebo koncentrací Na+.
Hyponatrémie může být také způsobena nadměrným příjmem vody, nekontrolovaným nedostatečnou funkcí ledvin..
V netradičním ošetření a použití
-Inhalační roztoky NaCl se používají k ředění léčiv používaných během procesu rozprašování. Používá se také pro tracheální výplach a zavlažování. 0,9% solný roztok používaný v nosních sprejích.
-Pro intraabniální transabdominální instalaci se používají 20% roztoky NaCl, což vyvolává pozdní potrat během druhého trimestru těhotenství..
-Jako místní antiseptikum lze použít chlorid sodný. Díky své osmotické kapacitě je schopen dehydratovat široké spektrum virů a bakterií v nestimulovaném stavu; proto se používá jako bolestivé antiseptikum k dezinfekci ran.
Toxicita
Požití
Zdraví škodlivý účinek má pouze při vysokém a dlouhodobém příjmu. Za těchto okolností by došlo k hypernatrémii s následným zvýšením extracelulárního objemu, který by vedl k arteriální hypertenzi..
Podráždění a fyzický kontakt
Má toxický účinek, pouze pokud je vdechování velmi vysoké. Nadměrný kontakt s pokožkou může způsobit její vysušení. Nakonec způsobí krátkodobé podráždění při kontaktu s očima.
Reference
- Shiver & Atkins. (2008). Anorganická chemie. (Čtvrté vydání., Str. 84, 90, 93, 263). Mc Graw Hill.
- Whitten, Davis, Peck a Stanley. Chemie. (8. vydání). CENGAGE Learning, s. 482-483.
- Chlorid sodný. (2018). Chlorid sodný: výhody, použití, vlastnosti, rizika. Převzato z: chlorid sodný.org
- PubChem. (2018). Chlorid sodný. Obnoveno z: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2018). Chlorid sodný. Převzato z: en.wikipedia.org
- Americké prvky. (2018). Chlorid sodný. Převzato z: americanelements.com



Zatím žádné komentáře