
Vyjádření chemické koncentrace, jednotky, Molalita

The chemická koncentrace je numerická míra relativního množství rozpuštěné látky v roztoku. Toto opatření vyjadřuje poměr rozpuštěné látky k množství nebo objemu rozpouštědla nebo roztoku v jednotkách koncentrace. Termín „koncentrace“ souvisí s množstvím přítomné rozpuštěné látky: roztok bude koncentrovanější, čím více rozpuštěné látky má.
Tyto jednotky mohou být fyzikální, když se vezmou v úvahu hmotnostní a / nebo objemové velikosti roztoku nebo chemických složek, když je koncentrace rozpuštěné látky vyjádřena jako její mol nebo ekvivalenty, přičemž se jako referenční hodnota použije Avogadrovo číslo..

Použitím molekulárních nebo atomových hmotností a Avogadrova čísla je tedy možné převést fyzikální jednotky na chemické jednotky při vyjádření koncentrace dané rozpuštěné látky. Proto lze všechny jednotky převést na stejné řešení.
Rejstřík článků
- 1 Zředěné a koncentrované roztoky
- 2 způsoby vyjádření koncentrace
- 2.1 Kvalitativní popis
- 2.2 Klasifikace podle rozpustnosti
- 2.3 Kvantitativní zápis
- 3 koncentrační jednotky
- 3.1 Relativní koncentrační jednotky
- 3.2 Jednotky zředěné koncentrace
- 3.3 Jednotky koncentrace jako funkce krtků
- 3.4 Formálnost a normálnost
- 4 Molarita
- 4.1 Cvičení 1
- 4.2 Cvičení 2
- 5 Normálnost
- 5.1 Výpočet
- 5.2 Cvičení 1
- 6 Molalita
- 6.1 Cvičení 1
- 7 Důležité poznámky a doporučení o chemické koncentraci
- 7.1 Objem roztoku je vždy větší než objem rozpouštědla
- 7.2 Utility molarity
- 7.3 Vzorce se nezapamatují, ale jednotky nebo definice ano
- 8 Reference
Zředěné a koncentrované roztoky
Jak poznáte, zda je koncentrace velmi zředěná nebo koncentrovaná? Na první pohled projevem kterékoli z jeho organoleptických nebo chemických vlastností; tj. ty, které smysly vnímají nebo které lze měřit.
Obrázek výše ukazuje ředění koncentrace dichromanu draselného (K.dvaCrdvaNEBO7), který vykazuje oranžovou barvu. Zleva doprava můžete vidět, jak barva snižuje svou intenzitu, jak se koncentrace ředí a přidává další rozpouštědlo.
Toto ředění umožňuje tímto způsobem získat zředěnou koncentraci z koncentrované. Barva (a další „skryté“ vlastnosti v jeho oranžovém jádru) se mění stejným způsobem jako jeho koncentrace, ať už s fyzickými nebo chemickými jednotkami..
Ale jaké jsou chemické jednotky koncentrace? Mezi nimi je molarita nebo molární koncentrace roztoku, která se týká molů rozpuštěné látky a celkového objemu roztoku v litrech.
Existuje také molalita nebo také molalová koncentrace, která označuje moly rozpuštěné látky, ale které jsou obsaženy ve standardizovaném množství rozpouštědla nebo rozpouštědla, které je přesně jeden kilogram.
Toto rozpouštědlo může být čisté, nebo pokud roztok obsahuje více než jedno rozpouštědlo, bude molalita znamenat mol rozpuštěné látky na kilogram směsi rozpouštědel..
A třetí jednotka chemické koncentrace je normálnost nebo normální koncentrace roztoku, která vyjadřuje počet chemických ekvivalentů rozpuštěné látky na litr roztoku.
Jednotka, ve které je normálnost vyjádřena, je v ekvivalentech na litr (Eq / L) a v medicíně je koncentrace elektrolytů v lidském séru vyjádřena v miliekvivalentech na litr (mEq / L).
Způsoby vyjádření koncentrace

Koncentraci roztoku lze označit třemi hlavními způsoby, přestože mají samy o sobě širokou škálu termínů a jednotek, které lze použít k vyjádření míry této hodnoty: kvalitativní popis, kvantitativní notace a klasifikace z hlediska rozpustnosti.
V závislosti na jazyce a kontextu, ve kterém pracujete, bude vybrán jeden ze tří způsobů vyjádření koncentrace směsi.
Kvalitativní popis
Kvalitativní popis koncentrace směsi, který se používá hlavně v neformálním a netechnickém jazyce, je vyjádřen ve formě přídavných jmen, která obecně označují úroveň koncentrace, kterou má roztok.
Tímto způsobem je minimální úroveň koncentrace podle kvalitativního popisu úroveň „zředěného“ roztoku a maximální je úroveň „koncentrovaného“..
Mluvíme o zředěných roztocích, když má roztok velmi malý podíl rozpuštěné látky v závislosti na celkovém objemu roztoku. Chcete-li zředit roztok, musíte přidat více rozpouštědla nebo najít způsob, jak snížit rozpuštěnou látku.
Nyní hovoříme o koncentrovaných řešeních, když mají vysoký podíl rozpuštěné látky jako funkce celkového objemu roztoku. Chcete-li koncentrovat roztok, musíte přidat více rozpuštěné látky nebo snížit množství rozpouštědla.
V tomto smyslu se této klasifikaci říká kvalitativní popis, a to nejen proto, že postrádá matematická měření, ale také kvůli své empirické kvalitě (lze ji přičíst vizuálním vlastnostem, vůni a chuti, aniž by bylo nutné provádět vědecké testy)..
Klasifikace podle rozpustnosti
Rozpustnost koncentrace označuje maximální kapacitu rozpuštěné látky, kterou má roztok, v závislosti na podmínkách, jako je teplota, tlak a látky, které jsou rozpuštěny nebo v suspenzi..
Roztoky lze rozdělit do tří typů podle úrovně rozpuštěné látky v době měření: nenasycené, nasycené a přesycené roztoky.
- Nenasycené roztoky jsou ty, které obsahují méně rozpuštěné látky, než kolik může roztok rozpustit. V tomto případě nedosáhlo řešení maximální koncentrace.
- Nasycené roztoky jsou ty, ve kterých se v rozpouštědle při určité teplotě rozpustilo maximální možné množství rozpuštěné látky. V takovém případě existuje rovnováha mezi oběma látkami a roztok nemůže přijmout více rozpuštěných látek (protože se vysráží).
- Přesycené roztoky mají více rozpuštěných látek, než by roztok přijal za rovnovážných podmínek. Toho je dosaženo zahřátím nasyceného roztoku a přidáním více rozpuštěné látky, než je obvyklé. Po vychladnutí nebude automaticky srážet solut, ale jakékoli narušení může způsobit tento efekt kvůli jeho nestabilitě..
Kvantitativní notace
Při studiu řešení, které má být použito v technické nebo vědecké oblasti, je vyžadována přesnost měřená a vyjádřená v jednotkách, které popisují koncentraci podle jejích přesných hodnot hmotnosti a / nebo objemu..
To je důvod, proč existuje řada jednotek používaných k vyjádření koncentrace roztoku v jeho kvantitativním zápisu, které jsou rozděleny na fyzikální a chemické a které zase mají své vlastní členění.
Jednotkami fyzických koncentrací jsou jednotky „relativní koncentrace“, které jsou vyjádřeny v procentech. Existují tři způsoby, jak vyjádřit procentuální koncentrace: procenta hmotnosti, procenta objemu a procenta objemu hmoty..
Místo toho jsou jednotky chemických koncentrací založeny na molárních množstvích, gramových ekvivalentech, částech na milion a dalších charakteristikách rozpuštěné látky ve vztahu k roztoku..
Tyto jednotky jsou nejběžnější díky své vysoké přesnosti při měření koncentrací, a proto jsou to obvykle ty, které chcete znát pro práci s chemickými roztoky..
Koncentrační jednotky
Jak je popsáno v předchozích částech, při kvantitativní charakterizaci koncentrace roztoku se výpočty musí pro tento účel řídit stávajícími jednotkami..
Podobně jsou koncentrační jednotky rozděleny na jednotky relativní koncentrace, jednotky zředěné koncentrace, jednotky založené na molech a další další..
Jednotky relativní koncentrace
Relativní koncentrace jsou koncentrace vyjádřené v procentech, jak je uvedeno v předchozí části. Tyto jednotky jsou rozděleny na hmotnostní procento, objemové procento a objemové procento a počítají se takto:
- % hmotnost = hmotnost rozpuštěné látky (g) / hmotnost celkového roztoku (g) x 100
- % objemu = objem rozpuštěné látky (ml) / objem celkového roztoku (ml) x 100
- % hmotnost / objem = hmotnost rozpuštěné látky (g) / objem celkového roztoku (ml) x 100
V tomto případě se k výpočtu hmotnosti nebo objemu celkového roztoku musí přidat hmotnost nebo objem rozpuštěné látky k hmotnosti nebo objemu rozpouštědla..
Jednotky zředěné koncentrace
Zředěné koncentrační jednotky jsou ty, které se používají k vyjádření těch velmi malých koncentrací, které se nacházejí ve formě stop ve zředěném roztoku; Nejběžnějším použitím těchto jednotek je najít stopy jednoho plynu rozpuštěného v jiném, například látky znečišťující vzduch.
Tyto jednotky jsou označeny ve formě dílů na milion (ppm), dílů na miliardu (ppb) a dílů na bilion (ppt) a jsou vyjádřeny takto:
- ppm = 1 mg rozpuštěné látky / 1 litr roztoku
- ppb = 1 μg rozpuštěné látky / 1 litr roztoku
- ppt = 1 ng rozpuštěné látky / 1 l roztoku
V těchto výrazech se mg rovná miligramům (0,001 g), μg se rovná mikrogramům (0,000001 g) a ng se rovná nanogramům (0,000000001 g). Tyto jednotky lze také vyjádřit jako funkci objemu / objemu.
Koncentrační jednotky jako funkce krtků
Koncentrační jednotky založené na molech jsou jednotky molární frakce, molární procento, molarita a molalita (poslední dvě jsou lépe popsány na konci článku).
Molární zlomek látky je zlomek všech jejích základních molekul (nebo atomů) jako funkce celkových molekul nebo atomů. Vypočítává se takto:
XNA = počet molů látky A / celkový počet molů v roztoku
Tento postup se opakuje pro ostatní látky v roztoku s přihlédnutím k součtu XNA + XB + XC ... musí se rovnat jedné.
Molární procento je zpracováno podobným způsobem jako XNA, pouze v procentech:
Molární procento A = XNA x 100%
Závěrečná část bude podrobně diskutovat o molaritě a molalitě..
Formálnost a normálnost
Nakonec existují dvě jednotky koncentrace, které se v současné době nepoužívají: formalita a normalita..
Formálnost řešení představuje počet hmotnostních vzorců na gram celkového roztoku na litr. Vyjadřuje se jako:
F = No. P.F.G / L solution
V tomto výrazu se P.F.G rovná hmotnosti každého atomu látky, vyjádřené v gramech.
Normálnost místo toho představuje počet ekvivalentů solutu dělený litry roztoku, jak je uvedeno níže:
N = ekvivalentní gramy rozpuštěné látky / litr roztoku
V tomto výrazu lze vypočítat ekvivalentní gramy rozpuštěné látky podle počtu molů H+, Ach- nebo jiné metody, v závislosti na typu molekuly.
Molarita
Molarita nebo molární koncentrace rozpuštěné látky je jednotka chemické koncentrace, která vyjadřuje nebo souvisí s moly rozpuštěné látky (n), které jsou obsaženy v jednom (1) litru (L) roztoku.
Molarita je označena velkým písmenem M a pro určení molů rozpuštěné látky (n) se gramy rozpuštěné látky (g) dělí molekulovou hmotností (MW) rozpuštěné látky..
Podobně se molekulová hmotnost MW rozpuštěné látky získá ze součtu atomových hmotností (PA) nebo atomové hmotnosti chemických prvků, s přihlédnutím k poměru, ve kterém se spojí za vzniku rozpuštěné látky. Různé soluty tedy mají své vlastní PM (i když tomu tak není vždy).
Tyto definice jsou shrnuty v následujících vzorcích, které se používají k provedení příslušných výpočtů:
Molarita: M = n (moly rozpuštěné látky) / V (litr roztoku)
Počet molů: n = g rozpuštěné látky / MW rozpuštěné látky
Cvičení 1
Vypočítejte molaritu roztoku připraveného se 45 g Ca (OH)dva rozpustí ve 250 ml vody.
První věc, kterou je třeba vypočítat, je molekulová hmotnost Ca (OH)dva (hydroxid vápenatý). Podle svého chemického vzorce je sloučenina tvořena kationem vápníku a dvěma hydroxylovými anionty. Zde je hmotnost elektronu menší nebo větší než druh zanedbatelná, takže se berou atomové hmotnosti:
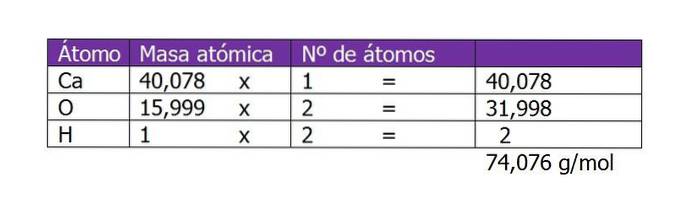
Počet molů rozpuštěné látky pak bude:
n = 45 g / (74 g / mol)
n = 0,61 mol Ca (OH)dva
Získá se 0,61 mol rozpuštěné látky, ale je důležité si uvědomit, že tyto moly leží rozpuštěné ve 250 ml roztoku. Protože definice molarity je mol v a litr nebo 1 000 ml, pak musí být provedeno jednoduché pravidlo tří pro výpočet molů, které jsou v 1 000 ml uvedeného roztoku
Pokud ve 250 ml roztoku existuje => 0,61 mol rozpuštěné látky
V 1000 ml roztoku => x Kolik je tam krtků?
x = (0,61 mol) (1 000 ml) / 250 ml
X = 2,44 M (mol / L)
Jiná cesta
Jiný způsob, jak získat moly pro aplikaci vzorce, vyžaduje, aby 250 ml bylo odebráno na litry, přičemž se také použije pravidlo tří:
Pokud 1 000 ml => je 1 litr
250 ml => x Kolik litrů je?
x = (250 ml) (1 l) / 1000 ml
x = 0,25 l
Nahrazení pak ve vzorci Molarity:
M = (0,61 mol rozpuštěné látky) / (0,25 l roztoku)
M = 2,44 mol / l
Cvičení 2
Co to znamená, aby byl roztok HCl 2,5 M?
Roztok HC1 je 2,5 molární, to znamená, že jeho jeden litr rozpustil 2,5 mol kyseliny chlorovodíkové..
Normální
Normálnost nebo ekvivalentní koncentrace je jednotka chemické koncentrace roztoků, která je označena velkým písmenem N. Tato jednotka koncentrace označuje reaktivitu rozpuštěné látky a rovná se počtu ekvivalentů rozpuštěné látky (Eq) mezi objemem roztoku vyjádřeným v litrech.
N = ekv. / L
Počet ekvivalentů (Eq) se rovná gramům rozpuštěné látky děleno ekvivalentní hmotností (PEq).
Eq = g rozpuštěná látka / PEq
Ekvivalentní hmotnost nebo také gramní ekvivalent se vypočítá tak, že se získá molekulová hmotnost rozpuštěné látky a vydělí se ekvivalentním faktorem, který se pro účely shrnutí do rovnice nazývá delta zeta (ΔZ).
PEq = PM / ΔZ
Výpočet
Výpočet normality bude mít velmi specifickou změnu v ekvivalentním faktoru nebo ΔZ, která také závisí na typu chemické reakce, které se účastní rozpuštěná látka nebo reaktivní látka. Některé případy této variace lze uvést níže:
-Pokud jde o kyselinu nebo zásadu, ΔZ nebo ekvivalentní faktor se bude rovnat počtu vodíkových iontů (H+) nebo hydroxylová skupina OH- která má rozpuštěnou látku. Například kyselina sírová (HdvaSW4) má dva ekvivalenty, protože má dva kyselé protony.
-Pokud jde o oxidačně-redukční reakce, ΔZ bude odpovídat počtu elektronů zapojených do procesu oxidace nebo redukce, v závislosti na konkrétním případě. Zde přichází na řadu vyvážení chemických rovnic a specifikace reakce..
-Podobně tento ekvivalentní faktor nebo ΔZ bude odpovídat počtu iontů, které se vysráží v reakcích klasifikovaných jako srážení..
Cvičení 1
Určete normálnost 185 g NadvaSW4 nalezeno v 1,3 l roztoku.
Nejprve se vypočítá molekulová hmotnost rozpuštěné látky v tomto roztoku:
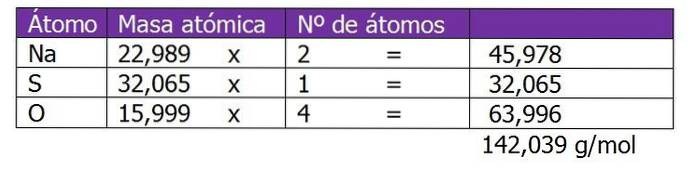
Druhým krokem je výpočet ekvivalentního faktoru nebo ΔZ. V tomto případě, protože síran sodný je sůl, bude uvažována valence nebo náboj kationtu nebo kovu Na.+, který se vynásobí 2, což je dolní index chemického vzorce soli nebo rozpuštěné látky:
NadvaSW4 => ∆Z = Valencia Cation x Dolní index
∆Z = 1 x 2
Chcete-li získat ekvivalentní hmotnost, nahradí se v příslušné rovnici:
PEq = (142,039 g / mol) / (2 ekv. / Mol)
PEq = 71,02 g / ekv
A pak můžete přistoupit k výpočtu počtu ekvivalentů a znovu se uchýlit k dalšímu jednoduchému výpočtu:
Eq = (185 g) / (71,02 g / ekv.)
Počet ekvivalentů = 2,605 ekv
Nakonec se se všemi potřebnými údaji normálnost nyní vypočítá dosazením podle její definice:
N = 2,605 ekv. / 1,3 l
N = 2,0 N
Molalita
Molalita je označena malým písmenem m y se rovná molům rozpuštěné látky, které jsou přítomné v jednom (1) kilogramu rozpouštědla. Je také známá jako koncentrace molalů a vypočítává se pomocí následujícího vzorce:
m = mol rozpuštěné látky / kg rozpouštědla
Zatímco Molarity stanoví poměr molů rozpuštěné látky obsažené v jednom (1) litru roztoku, molalita se týká molů rozpuštěné látky, které existují v jednom (1) kilogramu rozpouštědla.
V případech, kdy je roztok připraven s více než jedním rozpouštědlem, bude molalita vyjadřovat stejné moly rozpuštěné látky na kilogram směsi rozpouštědel..
Cvičení 1
Určete molalitu roztoku, který byl připraven smícháním 150 g sacharózy (C.12H220jedenáct) s 300 g vody.
Molekulová hmotnost sacharózy se nejprve stanoví k výpočtu molů rozpuštěné látky v tomto roztoku:
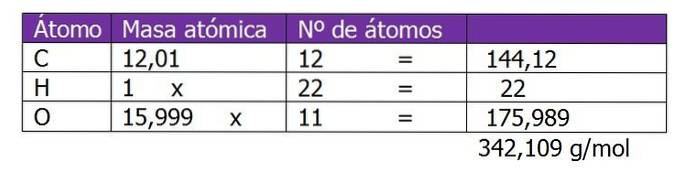
Počítá se počet molů sacharózy:
n = (150 g sacharózy) / (342,109 g / mol)
n = 0,438 molů sacharózy
Poté se gramy rozpouštědla vezmou na kilogramy, aby bylo možné použít konečný vzorec.
Nahrazení poté:
m = 0,438 molů sacharózy / 0,3 kilogramu vody
m = 1,46 mol C12H220jedenáct/ Kg HdvaNEBO
Ačkoli v současné době probíhá debata o konečném vyjádření molality, lze tento výsledek vyjádřit také jako:
1,26 m C12H220jedenáct nebo 1,26 molal
Někdy je považováno za výhodné vyjádřit koncentraci roztoku z hlediska molality, protože hmotnosti rozpuštěné látky a rozpouštědla neutrpí mírné výkyvy nebo neočekávané změny v důsledku účinků teploty nebo tlaku; jak se to děje v roztocích s plynnou rozpuštěnou látkou.
Kromě toho je zdůrazněno, že tato jednotka koncentrace vztažená na konkrétní rozpuštěnou látku se nezmění existencí dalších rozpuštěných látek v roztoku..
Doporučení a důležité poznámky o chemické koncentraci
Objem roztoku je vždy větší než objem rozpouštědla
Při řešení úloh řešení vzniká chyba při interpretaci objemu roztoku, jako by to byl objem rozpouštědla. Například pokud je gram práškové čokolády rozpuštěn v litru vody, objem roztoku se nerovná objemu litru vody..
Proč ne? Protože rozpuštěná látka bude vždy zabírat prostor mezi molekulami rozpouštědla. Pokud má rozpouštědlo vysokou afinitu k rozpuštěné látce, může být změna objemu po rozpuštění zanedbatelná nebo zanedbatelná..
Pokud však není, a ještě více, pokud je množství rozpuštěné látky velké, je třeba vzít v úvahu změnu objemu. Tímto způsobem: Vsolvent + Vsolute = Vsolution. Pouze ve zředěných roztocích nebo tam, kde je množství rozpuštěné látky malé, platí Vsolvent = Vsolution.
Tuto chybu je třeba mít na paměti zejména při práci s kapalnými látkami. Například pokud se místo rozpuštění práškové čokolády rozpustí med v alkoholu, pak bude mít objem přidaného medu významný vliv na celkový objem roztoku..
Proto v těchto případech musí být objem rozpuštěné látky přidán k objemu rozpouštědla..
Užitečnost molarity
-Znalost molarity koncentrovaného roztoku umožňuje provádět výpočty ředění pomocí jednoduchého vzorce M1V1 = M2V2, kde M1 odpovídá počáteční molaritě roztoku a M2 molaritě roztoku, který má být připraven z roztoku M1.
-Znát molaritu řešení, jeho normalitu lze snadno vypočítat pomocí následujícího vzorce: Normalita = počet ekvivalentů x M
Vzorce se nezapamatují, ale jednotky nebo definice ano
Někdy si však paměť nedokáže zapamatovat všechny rovnice související s výpočty koncentrace. K tomu je velmi užitečné mít velmi jasnou definici každého konceptu.
Z definice se jednotky zapisují pomocí konverzní faktory vyjádřit ty, které odpovídají tomu, co chcete určit.
Například pokud máte molalitu a chcete ji převést na normální, postupujte následovně:
(mol / kg rozpouštědla) x (kg / 1 000 g) (g rozpouštědla / ml) (ml rozpouštědla / ml roztoku) (1 000 ml / l) (ekv. / mol)
Všimněte si, že (g rozpouštědla / ml) je hustota rozpouštědla. Termín (ml rozpouštědla / ml roztoku) se vztahuje k tomu, kolik objemu roztoku skutečně odpovídá rozpouštědlu. V mnoha cvičeních je tento poslední termín z praktických důvodů roven 1, ačkoli to nikdy není úplně pravda..
Reference
- Úvodní chemie - 1Svatý Kanadské vydání. Kvantitativní jednotky koncentrace. Kapitola 11 Řešení. Převzato z: opentextbc.ca
- Wikipedia. (2018). Ekvivalentní koncentrace. Převzato z: en.wikipedia.org
- PharmaFactz. (2018). Co je to molarita? Převzato z: pharmafactz.com
- Whitten, Davis, Peck a Stanley. Chemie. (8. vydání). CENGAGE Learning, s. 101-103, 512, 513.
- Vodné roztoky - molarita. Převzato z: chem.ucla.edu
- Quimicas.net (2018). Příklady normality. Obnoveno z: quimicas.net.


Zatím žádné komentáře