
Struktura, vlastnosti, použití dodecylsulfátu sodného (SDS)
The dodecylsulfát sodný (SDS), je aniontová, syntetická a amfifilní organická sůl. Nepolární a hydrofobní část odpovídá uhlovodíkovému řetězci; zatímco polární a hydrofilní část je způsobena síranem se záporným nábojem.
SDS je povrchově aktivní látka: její molekuly jsou umístěny na povrch vodných roztoků, což vede ke snížení povrchového napětí. Tato funkce umožňuje jeho použití v šamponech, zubních pastách, mýdlech a jiných výrobcích pro osobní péči a čištění domácnosti..
Dodecylsulfát sodný se váže na protein a produkuje jeho rozvinutí a získává podlouhlý tvar. Sulfátové skupiny jsou vystaveny vodě a získávají záporné náboje, jejichž počet je úměrný jejich molekulové hmotnosti..
Z tohoto důvodu SDS umožňuje stanovení molekulových hmotností proteinů polyakrylamidovou elektroforézou..
Ačkoli existuje podezření na možný karcinogenní účinek SDS, nebylo prokázáno, že tomu tak je. SDS může stejně jako jiné čisticí prostředky způsobit podráždění kůže a očí..
Rejstřík článků
- 1 Struktura BL
- 1.1 Krystaly
- 1.2 Micely
- 2 Vlastnosti
- 2.1 Jména
- 2.2 Molekulární vzorec
- 2.3 Molární hmotnost
- 2.4 Fyzický popis
- 2.5 Zápach
- 2.6 Teplota tání
- 2.7 Rozpustnost ve vodě
- 2.8 Hustota
- 2.9 Stabilita
- 2.10 Rozklad
- 2.11 Povrchové napětí
- 2.12 Kritická molární koncentrace
- 3 použití
- 3.1 Osobní péče a úklid doma
- 3.2 Veterinární a humánní medicína
- 3.3 V laboratoři
- 3.4 Potravinářská přídatná látka
- 3.5 Průmysl
- 4 Rizika
- 5 Reference
Struktura BL
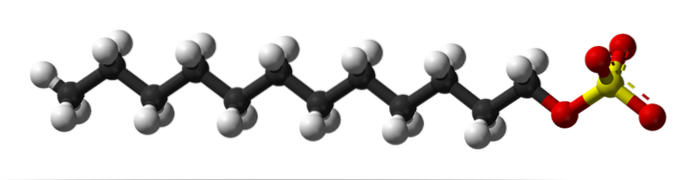
Na prvním obrázku byla molekula SDS ukázána pomocí modelu koulí a tyčí. Jak je vidět, má hydrofobní a nepolární karbonizovaný ocas (černé a bílé koule); a zároveň polární hlava, díky přítomnosti skupiny -SO4- (žlutá a červená koule).
I když to není zobrazeno, měla by existovat fialová koule představující kationt Na+, hned vedle skupiny -SO4-, elektrostaticky interagující.
To znamená, že je snadné pochopit, proč je tato sloučenina amfifilní; a také aniontový surfaktant, protože náboj SDS je negativní a může kromě Na přitahovat i další kationty+.
Molekula dává falešný dojem, že je tuhá, nepohyblivá lineární struktura. Je to však přesně naopak. SDS by se dal přirovnat k „šneku“, jehož sycený ocas vykazuje více vibrací a rotací svých jednoduchých vazeb. Díky tomu je schopen přijmout různé tvary nebo záhyby uprostřed; například ve vodě.
Krystaly
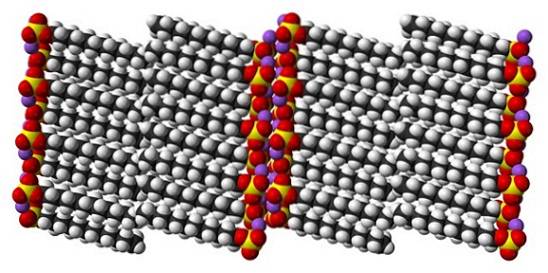
I když je pravda, že dodecylsulfát sodný je dynamická molekula, v pevném stavu se nemusí příliš pohybovat a chovat se jako „jednoduchá“ tyč. A tak je každá molekula nebo tyč umístěna takovým způsobem, aby se zvýšila interakce mezi karbonátovými konci a současně jejich iontovými náboji..
Výsledkem je tvorba monoklinického krystalu, kde jsou molekuly SDS zabaleny do několika sloupců sloupců (horní obrázek). Mezimolekulární síly, které je váží, jsou takové, že tyto krystaly vyžadují k roztavení do kapalné fáze teplotu 206 ° C..
Micely
Mimo pohodlí svých krystalů už nemůže molekula SDS zůstat klidná; začíná zkroutit ocas, aby zvýšil nebo snížil interakce s vnějším prostředím.
Pokud je tímto médiem voda, dochází k jevu, který se nazývá tvorba micel: karbonizované a hydrofobní ocasy se spojí, aby se navzájem vyzbrojily, zatímco polární hlavy, skupiny -SO4-, zůstávají na povrchu v interakci s molekulami H.dvaNEBO.
Micela pak nabývá zploštělou elipsoidní morfologii (jako Země, ale více zploštělá). Ve skle jsou jako bloky tyčí a ve vodném prostředí jako elipsoidní micely. Co když bylo médium mastné? Micela by byla obrácena: polární hlavy SO4- by šly do jádra, zatímco jejich sycené ocasy by byly vystaveny oleji.
Vlastnosti
Jména
- Dodecylsulfát sodný (SDS).
- Laurylsulfát sodný (SLS).
Molekulární vzorec
C12H25NEBO4SNa.
Molární hmotnost
288,378 g / mol.
Fyzický popis
Různé varianty: suchý prášek, kapalina nebo vlhká pevná látka. Jeho krystaly mají bílou nebo krémovou barvu.
Zápach
Slabý zápach mastných látek, bez zápachu.
Bod tání
206 ° C.
Rozpustnost ve vodě
1 105 mg / l 1 g rozpuštěný v 10 ml opalescentního roztoku.
Hustota
1,01 g / cm3.
Stabilita
Stabilní za doporučených skladovacích podmínek.
Rozklad
Při zahřátí na rozklad vydává bílý kouř z oxidu siřičitého a oxidu sodného.
Povrchové napětí
39,5 dyn / cm při 25 ° C.
Kritická molární koncentrace
V čisté vodě o teplotě 25 ° C je to 8,2 mM.
Aplikace
Osobní péče a domácí úklid
Dodecylsulfát je povrchově aktivní látka, která se používá v mnoha výrobcích, jako jsou mýdla na ruce, pěnové koupele, krémy na holení atd. Používá se také k odstranění těžko odstranitelných skvrn z oděvů, čištění podlah a koupelen, čištění kuchyňských předmětů atd..
Veterinární a humánní medicína
Používá se jako repelent na blechy a klíšťata přítomné u zvířat. Používá se také jako zvlhčovadlo v některých antibiotikách, k perorálnímu nebo topickému použití..
SDS je mikrobicidní proti obaleným virům, jako je HIV, typy 1 a 2, a proti viru herpes simplex (HSV-2). Působí také na neobalené viry: papilomavirus, reovirus, rotavirus a poliovirus. Toto použití však není schváleno..
Bylo navrženo použití SDS jako sprchy k zajištění ochrany před sexuálně přenosnými viry. Také při zpracování mateřského mléka k vyloučení nebo snížení možnosti přenosu HIV kojením.
Kromě antivirového účinku působí SDS na patogenní bakterie a houby. SDS odstraňuje rezistenci na léky a faktory přenosu pohlaví z E. coli; a blokuje růst mnoha grampozitivních bakterií.
V laboratoři
SDS se váže na proteiny a způsobuje jejich denaturaci, dodává jim negativní náboje a konformační změnu. To umožňuje stanovení jejich molekulárních hmot pomocí polyakrylamidové elektroforézy..
SDS se také používá při přípravě vzorků mozkové tkáně pro použití ve světelné mikroskopii. Používá se také při přípravě krevních vzorků pro počítání počtu erytrocytů..
SDS se používá při čištění nukleových kyselin díky své schopnosti rozpouštět membrány a inhibičnímu působení na aktivitu enzymů RNázy a DNázy..
Kromě toho se SDS používá při charakterizaci kvartérních amoniových sloučenin..
Potravinářská přídatná látka
SDS se používá jako emulgátor a zahušťovadlo v potravinách. Zlepšuje stabilitu a strukturu pečiva. Dále se používá jako pomocný prostředek při šlehání suchých vaječných výrobků..
Průmysl
SDS se používá v elektrolytickém průmyslu, zejména niklu a zinku; jako emulgátor a penetrant v laku a odstraňovači barev; ve složení vstřikovaných výbušnin; a v pevných raketových pohonných látkách jako pěnidlo.
Rizika
Konstantní expozice SDS může u morčat způsobit hyperplazii kůže. Králíci a lidé jsou k těmto zraněním méně náchylní. Přímý kontakt s SDS v koncentraci ≤ 20% může způsobit mírný zánět a podráždění pokožky.
Na druhé straně může dlouhodobá expozice SDS způsobit dermatitidu se známkami zarudnutí, otoku a puchýřů..
SDS může při kontaktu způsobit podráždění očí. U některých lidí může být také velmi reaktivní a při vdechování může způsobit podráždění dýchacích cest a dýchací potíže..
Ve vzácných případech může požití bezpečnostního listu způsobit poleptání. Bylo však hlášeno u dětí, které požívaly SDS, rychle se rozvíjející hojné zvracení, deprese CNS a dýchací potíže..
V SDS nebyly nalezeny žádné důkazy o genotoxicitě nebo teratogenním působení. U 242 pacientů s ekzematózní dermatitidou bylo zjištěno, že 6,4% pacientů mělo alergii, která byla způsobena použitím bezpečnostního listu.
Reference
- Strukturální data od L. A. Smitha, R. B. Hammonda, K. J. Robertsa, D. Machina, G. McLeoda (2000). Stanovení krystalové struktury bezvodého dodecylsulfátu sodného za použití kombinace práškové difrakce synchrotronového záření a technik molekulárního modelování. Journal of Molecular Structure 554 (2-3): 173-182. DOI: 10.1016 / S0022-2860 (00) 00666-9.
- Wikipedia. (2019). Dodecylsulfát sodný. Obnoveno z: en.wikipedia.org
- Národní centrum pro biotechnologické informace. (2019). Dodecylsulfát sodný. Databáze PubChem. CID = 3423265. Obnoveno z: pubchem.ncbi.nlm.nih.gov
- Hammouda B. (2013). Vliv teploty na nanostrukturu micel SDS ve vodě. Journal of research of the National Institute of Standards and Technology, 118, 151-167. doi: 10,6028 / jres.118.008
- Elsevier. (2019). Dodecylsulfát sodný. Science Direct. Obnoveno z: sciencedirect.com
- Kumar, S., Thejasenuo, J. K. a Tsipila, T. (2014). Toxikologické účinky dodecylsulfátu sodného. Journal of Chemical and Pharmaceutical Research 6 (5): 1488-1492.
- Toxikologická datová síť. (s.f.). Laurylsulfát sodný. Toxnet. Obnoveno z: toxnet.nlm.nih.gov



Zatím žádné komentáře