
Helmholtzovy volné energetické jednotky, jak to vypočítat, vyřešená cvičení
The Helmholtzova volná energie je termodynamický potenciál, který měří užitečnou práci uzavřeného systému za podmínek konstantní teploty a objemu. Helmholtzova volná energie se označuje jako F y je definováno jako rozdíl vnitřní energie NEBO minus součin teploty T entropií S:
F = U - T⋅S
Jelikož se jedná o energii, měří se v Joulech v mezinárodním systému (SI), i když dalšími vhodnými jednotkami mohou být také ergs (CGS), kalorie nebo elektronvolty (eV).

Negativní variace Helmholtzovy energie během procesu se rovná maximální práci, kterou může systém vykonat v izochorickém procesu, tj. Při konstantním objemu. Pokud hlasitost není udržována konstantní, lze některé z těchto prací provést v prostředí.
V tomto případě označujeme práci, při které se objem nemění, například elektrickou práci: dW = Φdq, s Φ jako elektrický potenciál a q jako elektrický náboj.
Pokud je teplota také konstantní, je Helmholtzova energie minimalizována, když je dosaženo rovnováhy. K tomu všemu je Helmholtzova energie zvláště užitečná v procesech s konstantním objemem. V tomto případě máte:
- Pro spontánní proces: ΔF < 0
- Když je systém v rovnováze: ΔF = 0
- V nespontánním procesu: ΔF> 0.
Rejstřík článků
- 1 Jak se vypočítává Helmholtzova volná energie??
- 1.1 Spontánní procesy
- 2 Vyřešená cvičení
- 2.1 Cvičení 1
- 2.2 Cvičení 2
- 3 Odkazy
Jak se počítá Helmholtzova volná energie??
Jak bylo uvedeno na začátku, Helmholtzova energie je definována jako „vnitřní energie U systému, minus součin absolutní teploty T systému, entropií S systému“:
F = U - T⋅S
Je to funkce teploty T a objemu V. Kroky k vizualizaci jsou následující:
- Počínaje prvním zákonem termodynamiky souvisí vnitřní energie U s entropií S systému a jeho objemem V pro reverzibilní procesy prostřednictvím následujícího diferenciálního vztahu:
dU = dQ - dW = TdS - PdV
Z toho vyplývá, že vnitřní energie U je funkcí proměnných S Y PROTI, Tím pádem:
U = U (S, V)
- Nyní vezmeme definici F a je odvozeno:
dF = dU - d (TS) = dU - TdS - SdT
- Nahrazením rozdílového výrazu získaného pro dU v prvním kroku zůstává:
dF = TdS - PoV - TdS - SdT = -SdT - PoV
- Nakonec se dospělo k závěru, že F je funkcí teploty T a objemu V a lze ji vyjádřit jako:
F = F (T, V)
Spontánní procesy
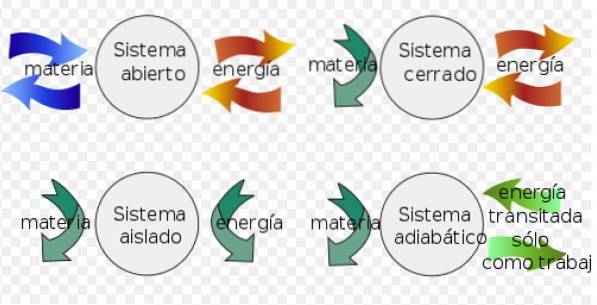
Helmholtzovu energii lze použít jako obecné kritérium spontánnosti v izolovaných systémech, ale nejprve je vhodné specifikovat některé koncepty:
- A systém uzavřen mohou vyměňovat energii s prostředím, ale nemohou vyměňovat hmotu.
- Místo toho izolovaný systém nevyměňuje hmotu ani energii s prostředím.
- Nakonec a otevřený systém vyměňovat hmotu a energii s prostředím.
V reverzibilních procesech se změna vnitřní energie počítá takto:
dU = TdS - PoV
Nyní předpokládejme proces při konstantním objemu (izochorický), ve kterém má druhý člen předchozího výrazu nulový příspěvek. Mělo by se také pamatovat na to, že podle Clausiova nerovnost:
dS ≥ dQ / T
Taková nerovnost platí pro izolovaný termodynamický systém.
Takže pro proces (reverzibilní nebo ne), ve kterém objem zůstává konstantní, platí následující:
T dS ≥ dU (při pevné hlasitosti)
Vzhledem k tomu, že:
dF = dU - T dS
Budeme mít, že v izochorickém procesu při konstantní teplotě je přesvědčeno, že: dF ≤ 0, jak je uvedeno na začátku.
Helmholtzova energie F je tedy klesající množství v spontánním procesu, pokud jde o izolovaný systém. F dosáhne své minimální a stabilní hodnoty, když bylo dosaženo reverzibilní rovnováhy.
Vyřešená cvičení
Cvičení 1
Vypočítejte variaci Helmholtzovy volné energie F pro 2 moly ideálního plynu při teplotě 300 K během izotermické expanze, která vezme systém z počátečního objemu 20 litrů na konečný objem 40 litrů.
Řešení
Počínaje definicí F:
F = U - TS
Konečná variace F, nazývaná ΔF, pak bude:
ΔF = ΔU - T ΔS
Protože prohlášení uvádí, že teplota je konstantní: ΔT = 0. Nyní v ideálních plynech závisí vnitřní energie pouze na jejich absolutní teplotě, ale protože se tedy jedná o izotermický proces ΔU = 0 Y ΔF = - T ΔS. Pro ideální plyny je změna entropie izotermického procesu napsána takto:
ΔS = n.R.ln (Vdva/ V1)
Použití tohoto výrazu:
ΔS = 2 moly x 8,314 J / (K mol) x ln (40L / 20L) = 11,53 J / K
A konečně, změna Helmholtzovy energie je:
ΔF = - T ΔS = - 300 K x 11,53 J / K = -3457,70 J.
Cvičení 2
Uvnitř válce je píst, který jej rozděluje na dvě části a na každé straně pístu jsou n moly ideálního monatomického plynu, jak je znázorněno na obrázku níže.
Stěny válce jsou dobrými vodiči tepla (diatermické) a jsou v kontaktu se zásobníkem teploty Tnebo.
Počáteční objem každé z částí válce je V1i a V2i, zatímco jeho konečné objemy jsou V1f a V2f po kvazi-statickém posunutí. Píst se pohybuje pomocí pístu, který hermeticky prochází dvěma víčky válců.
Je žádáno, aby našel:
a) Změna vnitřní energie plynu a práce systému a
b) Variace Helmholtzovy energie.
Řešení
Jelikož se píst pohybuje kvazi-staticky, musí vnější síla působící na píst vyrovnávat sílu v důsledku tlakového rozdílu ve dvou částech válce..
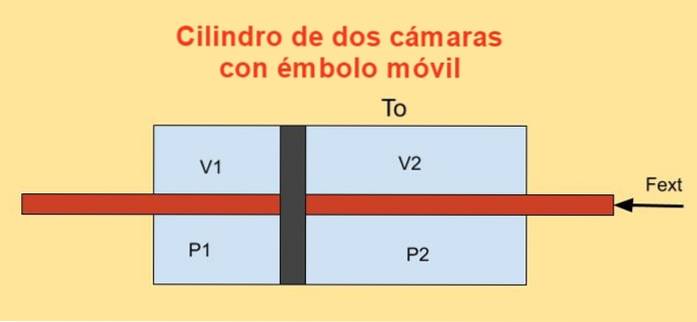
Práce dW provádí vnější silou Fext během nekonečně malého posunu dx to je:
dW = - Fext dx = (str1 - Pdva) a dx = P1 dV1 + Pdva dVdva
Kde byl vztah použit dV1 = - dVdva = a dx, bytost na oblast pístu. Na druhou stranu, variace Helmholtzovy energie je:
dF = -SdT - PdV
Protože se teplota během procesu nemění dT = 0 Y dF = - PoV. Aplikováním tohoto výrazu na každou část válce máme:
dW = P1 dV1 + Pdva dVdva = - dF1 - dFdva
Bytost F1 Y Fdva Helmholtzovy energie v každé z komor.
Konečnou práci W lze vypočítat z konečné variace Helmholtzovy energie každé komory:
W = -ΔF1 - ΔFdva
Řešení b
K nalezení změny v Helmholtzově energii se používá definice: F = U - TS. Stejně jako v každé komoře existuje monatomický ideální plyn při konstantní teplotě Tnebo, vnitřní energie se nemění (ΔU = 0), takže: ΔF = - Tnebo ΔS. Co víc:
ΔS = nR ln (VF/Viděl)
Že když substituce konečně umožňuje vykonanou práci:
W = -Tnebo nR ln (V.1f / V1i) - Do nR ln (V.2f / V2i) = -ΔF1 -ΔFdva
W = - Do nR ln [(V1f ⋅ V1i) / (V.2f .PROTI2i)] = - ΔFcelkový
Bytost ΔFcelkový celková změna Helmholtzovy energie.
Reference
- Kaštany E. Energetická cvičení zdarma. Obnoveno z: lidiaconlaquimica.wordpress.com
- Libretexts. Helmholtzova energie. Obnoveno z: chem.libretexts.org
- Libretexts. Co jsou to volné energie. Obnoveno z: chem.libretexts.org
- Wikipedia. Helmholtzova energie. Obnoveno z: es.wikipedia.com
- Wikipedia. Helmholtzova volná energie. Obnoveno z: en.wikipedia.com



Zatím žádné komentáře