
Sigma Link Jak se tvoří, charakteristika a příklady
The sigma odkaz (reprezentovaný jako σ) je unie kovalentního typu, která se vyznačuje sdílením dvou elektronů, ke kterému dochází mezi dvojicí atomů za vzniku uvedené vazby. Kromě toho se jedná o druh jednoduché vazby, ve které jsou oba atomy připojeny dvěma elektrony a tvoří jednoduchou vazbu..
Když se dva nebo více atomů spojí za vzniku nových molekulárních sloučenin, spojí se pomocí dvou typů vazeb: iontové a kovalentní, jejichž struktura závisí na tom, jak jsou elektrony rozděleny mezi oba atomy zapojené do této vazby..
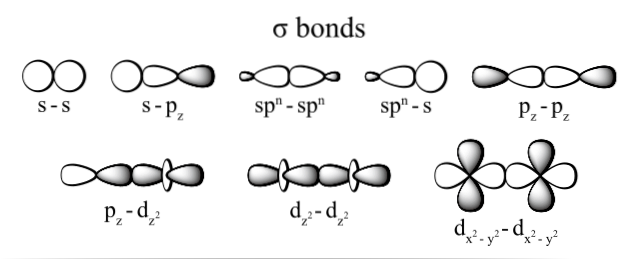
Spojení generované elektrony se provádí díky překrývání orbitalů, které patří každému atomu (jejich konci), pochopení orbitálů prostorů, kde je nejpravděpodobnější lokalizace elektronu v atomu a které jsou definovány elektronem hustota.
Rejstřík článků
- 1 Jak se tvoří?
- 1.1 Tvorba sigma vazeb v různých chemických druzích
- 2 Funkce
- 3 příklady
- 4 Odkazy
Jak se to formuje?
Je známo, že jednoduchá vazba mezi dvěma atomy je ekvivalentní jediné sigma vazbě..
Podobně tyto vazby vznikají díky superpozici nebo překrytí frontálním způsobem, ke kterému dochází mezi konci atomových orbitalů dvou různých atomů..
Tyto atomy, jejichž orbitaly se překrývají, musí navzájem sousedit, aby se jednotlivé elektrony patřící ke každému atomovému orbitalu mohly efektivně spojit a vytvořit vazbu..
Proto skutečnost, že elektronická distribuce, která se projevuje, nebo umístění hustoty elektronů z každé superpozice má válcovou symetrii kolem osy, která se vyskytuje mezi dvěma spojenými atomovými druhy..
V tomto případě lze takzvaný sigma orbitál snáze vyjádřit pomocí intramolekulárních vazeb, které se tvoří v diatomických molekulách, přičemž je třeba poznamenat, že existuje také několik typů sigma vazeb..
Nejčastěji pozorované typy vazby sigma jsou: dzdva+dzdva, s + pz, pz+pz a s + s; kde dolní index z představuje osu tvořenou vytvořeným poutem a každé písmeno (s, p a d) odpovídá okružní dráze.
Tvorba sigma vazeb v různých chemických druzích
Když hovoříme o molekulárních orbitálech, odkazuje se na oblasti, které akumulují nejvyšší elektronovou hustotu, když se vytvoří vazba tohoto typu mezi různými molekulami, která se získá kombinací atomových orbitalů..
Z hlediska kvantové mechaniky studie vyvodily, že orbitály molekulárního typu, které vykazují symetricky stejné chování, jsou ve skutečnosti kombinovány ve směsích (hybridizace).
Význam této kombinace orbitalů však úzce souvisí s relativními energiemi, které se projevují symetricky podobnými orbitaly molekulárního typu..
V případě organických molekul jsou často pozorovány cyklické druhy skládající se z jedné nebo více kruhových struktur, které jsou často tvořeny velkým počtem vazeb typu sigma ve spojení s vazbami typu pi (vícenásobné vazby)..
Ve skutečnosti je možné pomocí jednoduchých matematických výpočtů určit počet sigma vazeb přítomných v molekulárním druhu..
Existují také případy koordinačních sloučenin (s přechodnými kovy), ve kterých jsou kombinovány více vazeb s různými třídami vazebných interakcí, stejně jako molekuly tvořené různými typy atomů (polyatomové).
Vlastnosti
Sigma vazby mají jedinečné vlastnosti, které je jasně odlišují od jiných typů kovalentní vazby (pi vazba), mezi nimiž je i skutečnost, že tento typ vazby je nejsilnější mezi chemickými vazbami kovalentní třídy.
Je tomu tak proto, že překrývání orbitalů nastává přímo, koaxiálně (nebo lineárně) a frontálně; to znamená, že se získá maximální překrytí mezi orbitaly.
Navíc je elektronická distribuce v těchto spojích soustředěna hlavně mezi jádry atomových druhů, které jsou kombinovány..
K tomuto překrytí sigma orbitalů dochází třemi možnými způsoby: mezi dvojicí čistých orbitalů (s-s), mezi čistým orbitálem a hybridním typem (s-sp) nebo mezi dvojicí hybridních orbitalů (sp3- sp3).
K hybridizaci dochází díky směsi orbitalů atomového původu různých tříd, přičemž se získá, že výsledný hybridní orbitál závisí na množství každého z typů čistých počátečních orbitalů (například sp3 = jeden čistý s orbitál + tři čisté orbitaly typu p).
Kromě toho může sigma vazba existovat nezávisle, stejně jako připustit volný rotační pohyb mezi dvojicí atomů..
Příklady
Vzhledem k tomu, že kovalentní vazba je nejběžnějším druhem vazby mezi atomy, vazba sigma se nachází v obrovském množství chemických druhů, jak je vidět níže.
V molekulách diatomic plynu - jako je vodík (Hdva), kyslík (O.dva) a dusík (Ndva) - mohou se vyskytovat různé typy vazeb v závislosti na hybridizaci atomů.
V případě vodíku existuje jediná sigma vazba spojující oba atomy (H-H), protože každý atom přispívá svým jediným elektronem.
Na druhou stranu, v molekulárním kyslíku jsou oba atomy spojeny dvojnou vazbou (O = O) - to je vazba sigma - a vazba pi, přičemž každý atom je ponechán se třemi páry zbývajících elektronů spárovaných.
Místo toho má každý atom dusíku ve své nejvzdálenější energetické úrovni (valenčním plášti) pět elektronů, takže jsou spojeny trojnou vazbou (N≡N), což znamená přítomnost vazby sigma a dvou vazeb pí a dvojice spárovaných elektronů v každém atomu.
Stejným způsobem se vyskytuje ve sloučeninách cyklického typu s jednoduchými nebo vícenásobnými vazbami a ve všech druzích molekul, jejichž struktura je tvořena kovalentními vazbami..
Reference
- Wikipedia. (s.f.). Sigma vazba. Obnoveno z en.wikipedia.org
- Chang, R. (2007). Chemistry, deváté vydání. Mexiko: McGraw-Hill.
- ThoughtCo. (s.f.). Definice chemie Sigma Bond. Obnoveno z thoughtco.com
- Britannica, E. (s.f.). Sigma vazba. Obnoveno z britannica.com
- LibreTexts. (s.f.). Sigma a Pi Bonds. Obnoveno z chem.libretexts.org
- Srivastava, A. K. (2008). Organická chemie je jednoduchá. Obnoveno z books.google.co.ve



Zatím žádné komentáře