
Struktura krystalové struktury, typy a příklady
The Krystalická struktura Jedná se o jeden z pevných stavů, které mohou atomy, ionty nebo molekuly v přírodě přijmout, pro který je charakteristické vysoké prostorové uspořádání. Jinými slovy, je to důkaz „korpuskulární architektury“, která definuje mnoho těl sklovitě a leskle..
Co podporuje nebo jaká síla je zodpovědná za tuto symetrii? Částice nejsou samy, ale vzájemně na sebe působí. Tyto interakce spotřebovávají energii a ovlivňují stabilitu pevných látek, takže se částice snaží přizpůsobit, aby tuto ztrátu energie minimalizovaly..

Jejich přirozené přirozenosti je tedy vedly k tomu, aby se umístili do nejstabilnějšího prostorového uspořádání. Může to být například ten, kde odpory mezi ionty se stejnými náboji jsou minimální, nebo kde některé atomy - například kovové - zaujímají také největší možný objem v jejich obalech..
Slovo „krystal“ má chemický význam, který může být zkreslen pro jiná těla. Chemicky to znamená uspořádanou strukturu (mikroskopicky), která může například sestávat z molekul DNA (krystal DNA).
Obecně se však zneužívá k označení jakéhokoli sklovitého předmětu nebo povrchu, jako jsou zrcadla nebo lahve. Na rozdíl od pravých krystalů se sklo skládá z amorfní (neuspořádané) struktury silikátů a mnoha dalších přísad..
Rejstřík článků
- 1 Struktura
- 1.1 Jednotková buňka
- 2 druhy
- 2.1 Podle jeho krystalického systému
- 2.2 Podle své chemické povahy
- 3 příklady
- 3.1 K2Cr2O7 (triclinický systém)
- 3,2 NaCl (kubický systém)
- 3,3 ZnS (wurtzit, šestihranný systém)
- 3,4 CuO (monoklinický systém)
- 4 Odkazy
Struktura
Na obrázku výše jsou znázorněny některé smaragdové drahokamy. Stejně jako tyto, mnoho dalších minerálů, solí, kovů, slitin a diamantů vykazuje krystalickou strukturu; ale jaký vztah má jeho uspořádání se symetrií?
Pokud se na krystal, jehož částice lze pozorovat pouhým okem, aplikují operace symetrie (obrácení, otáčení v různých úhlech, odraz v rovině atd.), Pak se zjistí, že zůstává neporušený ve všech rozměrech prostoru..
U amorfní pevné látky nastává opak, ze kterého se získají různé řády podrobením operaci symetrie. Kromě toho postrádá strukturní opakovací vzorce, které ukazují náhodnost v distribuci jeho částic..
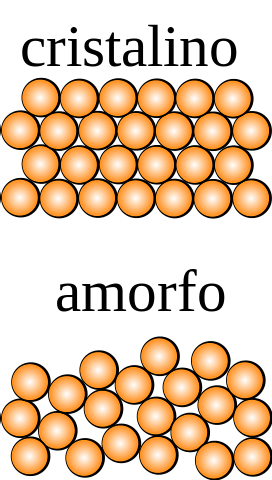
Jaká je nejmenší jednotka, která tvoří strukturní vzor? Na horním obrázku je krystalická pevná látka symetrická v prostoru, zatímco amorfní ne..
Pokud by byly nakresleny čtverce, na které by byly aplikovány uzavřené oranžové koule a operace symetrie, bylo by zjištěno, že generují další části krystalu.
Výše uvedené se opakuje s menšími a menšími čtverci, dokud nenajdete ten, který je asymetrický; ten, který mu předchází co do velikosti, je podle definice jednotková buňka.
Jednotková buňka
Jednotková buňka je minimální strukturní exprese, která umožňuje úplnou reprodukci krystalické pevné látky. Z toho je možné sklo sestavit a pohybovat s ním ve všech směrech prostoru.
Lze jej považovat za malou zásuvku (kufr, vědro, kontejner atd.), Kde jsou částice, představované koulemi, umístěny podle vzoru plnění. Rozměry a geometrie tohoto boxu závisí na délkách jeho os (a, b a c), jakož i na úhlech mezi nimi (α, β a γ).
Nejjednodušší ze všech jednotkových buněk je jednoduchá kubická struktura (horní obrázek (1)). V tomto zabírá střed koulí rohy krychle, čtyři na základně a čtyři na stropě..
V tomto uspořádání sféry zabírají pouze 52% z celkového objemu krychle, a protože příroda abstrahuje vakuum, tuto strukturu nepřijímá mnoho sloučenin nebo prvků..
Pokud jsou však koule uspořádány ve stejné krychli tak, že jedna zaujímá střed (kubický střed v těle, bcc), pak bude existovat kompaktnější a efektivnější obal (2). Nyní sféry zaujímají 68% celkového objemu.
Na druhou stranu v (3) žádná koule nezabírá střed krychle, ale střed jejích ploch, a všechny zabírají až 74% celkového objemu (krychlový centrovaný na obličej, krychlový).
Je tedy vidět, že pro stejnou krychli lze získat i jiná uspořádání, která mění způsob, jakým jsou koule zabaleny (ionty, molekuly, atomy atd.).
Typy
Krystalové struktury lze klasifikovat podle jejich krystalových systémů nebo chemické povahy jejich částic..
Například kubický systém je nejběžnější ze všech a řídí se ním mnoho krystalických pevných látek; Stejný systém však platí pro iontové i kovové krystaly..
Podle jeho krystalického systému
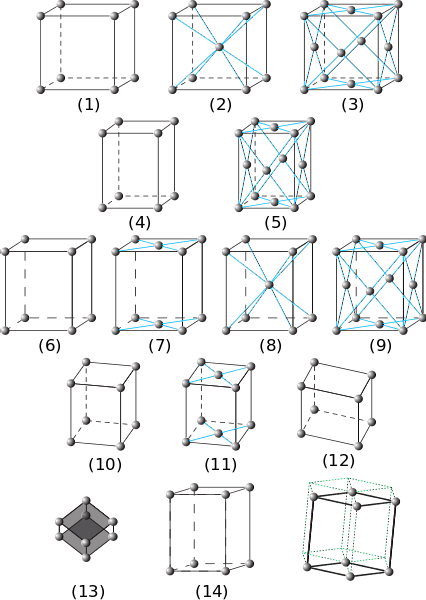
Na předchozím obrázku je znázorněno sedm hlavních krystalových systémů. Je možné poznamenat, že jich je ve skutečnosti čtrnáct, které jsou produktem jiných forem balení pro stejné systémy a tvoří sítě Bravais.
Od (1) do (3) jsou krystaly s krychlovými krystalovými systémy. V (2) je pozorováno (modrými pruhy), že koule ve středu a v rozích interagují s osmi sousedy, takže koule mají koordinační číslo 8. A v (3) je koordinační číslo 12 ( abyste to viděli, musíte duplikovat kostku v libovolném směru).
Prvky (4) a (5) odpovídají jednoduchým a na obličej centrovaným tetragonálním systémům. Na rozdíl od kubiku je jeho osa c delší než osy aab.
Od (6) do (9) jsou ortorombické systémy: od jednoduchých a se středem na základnách (7), po ty, které jsou soustředěny na těle a na tvářích. V těchto α, β a γ jsou 90 °, ale všechny strany mají různou délku.
Obrázky (10) a (11) jsou monoklinické krystaly a (12) je triclinický, poslední představuje nerovnosti ve všech svých úhlech a osách..
Prvek (13) je kosodélníkový systém, analogický kubickému, ale s úhlem γ odlišným od 90 °. Konečně jsou tu šestihranné krystaly
Posunutí prvků (14) vytváří šestihranný hranol sledovaný zelenými tečkovanými čarami.
Podle jeho chemické povahy
- Pokud jsou krystaly složeny z iontů, jedná se o iontové krystaly přítomné v solích (NaCl, CaSO4, CuCldva, KBr atd.)
- Molekuly jako glukóza tvoří (kdykoli mohou) molekulární krystaly; v tomto případě slavné krystaly cukru.
- Atomy, jejichž vazby jsou v podstatě kovalentní, tvoří kovalentní krystaly. Takové jsou případy karbidu diamantu nebo křemíku.
- Také kovy jako zlato tvoří kompaktní kubické struktury, které tvoří kovové krystaly..
Příklady
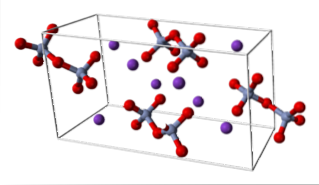
K.dvaCrdvaNEBO7 (triclinický systém)
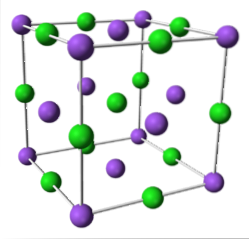
NaCl (kubický systém)
ZnS (wurtzit, šestihranný systém)
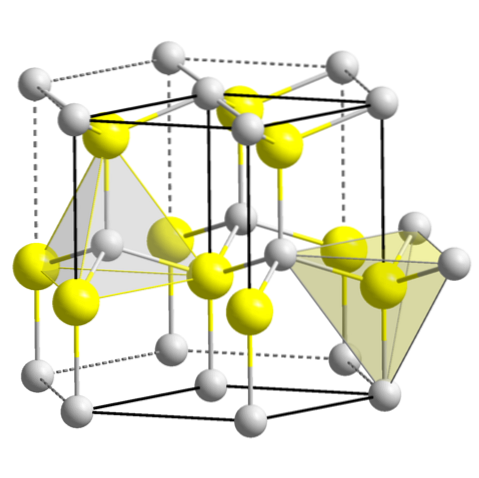
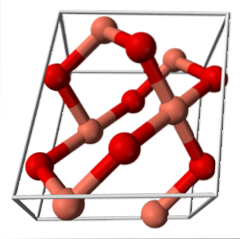
CuO (monoklinický systém)
Reference
- Quimitube. (2015). Proč „krystaly“ nejsou krystaly. Citováno dne 24. května 2018 z: quimitube.com
- Tiskové knihy. 10.6 Mřížkové struktury v krystalických tělesech. Citováno dne 26. května 2018 z: opentextbc.ca
- Centrum akademických zdrojů krystalických struktur. [PDF]. Citováno dne 24. května 2018 z: web.iit.edu
- Ming. (30. června 2015). Typy krystalových struktur. Citováno dne 26. května 2018 z: crystalvisions-film.com
- Helmenstine, Anne Marie, Ph.D. (31. ledna 2018). Druhy krystalů. Citováno dne 26. května 2018 z: thoughtco.com
- KHI. (2007). Krystalické struktury. Citováno dne 26. května 2018 z: folk.ntnu.no
- Paweł Maliszczak. (25. dubna 2016). Drsné smaragdové krystaly z údolí Panjshir v Afghánistánu. [Postava]. Citováno dne 24. května 2018 z: commons.wikimedia.org
- Napy1kenobi. (26. dubna 2008). Bravais svazy. [Postava]. Citováno dne 26. května 2018 z: commons.wikimedia.org
- Uživatel: Sbyrnes321. (21. listopadu 2011). Krystalický nebo amorfní. [Postava]. Citováno dne 26. května 2018 z: commons.wikimedia.org



Zatím žádné komentáře