
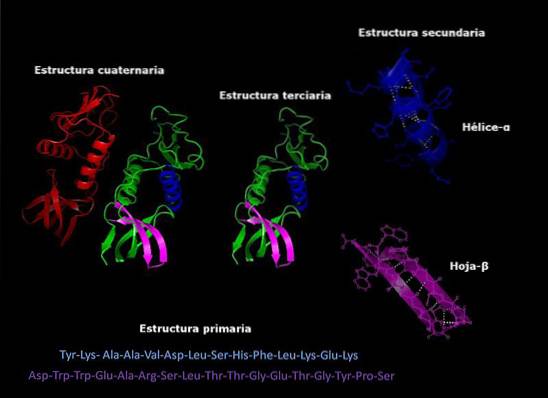
Primární struktura charakteristických proteinů
The primární struktura bílkovin Je to pořadí, ve kterém jsou uspořádány aminokyseliny polypeptidu nebo polypeptidů, které je obsahují. Protein je biopolymer vyrobený z a-aminokyselinových monomerů spojených peptidovými vazbami. Každý protein má definovanou sekvenci těchto aminokyselin.
Proteiny plní širokou škálu biologických funkcí, včetně formování a udržování integrity buněk prostřednictvím cytoskeletu, obrany těla před cizími látkami pomocí protilátek a katalyzování chemických reakcí v těle prostřednictvím enzymů..
Dnes je určování složení proteinů a pořadí, ve kterém jsou aminokyseliny uspořádány (sekvenování), rychlejší než před lety. Tyto informace jsou uloženy v mezinárodních elektronických databázích, do kterých lze přistupovat prostřednictvím internetu (mimo jiné GenBank, PIR).
Rejstřík článků
- 1 Aminokyseliny
- 1.1 Alifatické aminokyseliny
- 1.2 Aminokyseliny s postranními řetězci obsahujícími hydroxylovou skupinu nebo síru
- 1.3 Cyklické aminokyseliny
- 1.4 Aromatické aminokyseliny
- 1.5 Základní aminokyseliny
- 1.6 Kyselé aminokyseliny a jejich amidy
- 2 Peptidové vazby
- 3 Sekvence aminokyselin
- 4 Kódování proteinů
- 5 Reference
Aminokyseliny
Aminokyseliny jsou molekuly, které obsahují aminoskupinu a skupinu karboxylové kyseliny. V případě a-aminokyselin mají centrální atom uhlíku (α uhlík), ke kterému jsou připojeny jak aminoskupina, tak karboxylová skupina, stejně jako atom vodíku a výrazná skupina R, která se nazývá postranní řetězec.
Díky této konfiguraci a-uhlíku jsou vytvořené aminokyseliny, známé jako a-aminokyseliny, chirální. Jsou vytvořeny dvě formy, které jsou vzájemně zrcadlovými obrazy a nazývají se L a D enantiomery..
Všechny proteiny v živých bytostech jsou tvořeny 20 a-aminokyselinami konfigurace L. Postranní řetězce těchto 20 aminokyselin jsou odlišné a mají velkou rozmanitost chemických skupin.
V zásadě mohou být a-aminokyseliny seskupeny (libovolně) v závislosti na typu postranního řetězce následovně.
Alifatické aminokyseliny
V této skupině jsou podle některých autorů obsaženy glycin (Gli), alanin (Ala), valin (Val), leucin (Leu) a izoleucin (Ile). Mezi další autory patří také methionin (met) a prolin (pro).
Aminokyseliny s postranními řetězci obsahujícími hydroxyl nebo síru
Obsahuje Serin (Ser), Cystein (Cys), Threonin (Thr) a také Methionin. Podle některých autorů by skupina měla zahrnovat pouze Ser a Thr.
Cyklické aminokyseliny
Je tvořen výhradně prolinem, který, jak již bylo uvedeno, je mezi alifatickými aminokyselinami zahrnut jinými autory.
Aromatické aminokyseliny
Fenylalanin (Phe), tyrosin (Tyr) a tryptofan (Trp).
Základní aminokyseliny
Histidin (His), Lysin (Lys) a Arginin (Arg)
Kyselé aminokyseliny a jejich amidy
Obsahuje kyseliny asparagové (Asp) a glutamové (Glu) a také amidy Aspargin (Asn) a Glutamin (Gln). Někteří autoři rozdělují tuto poslední skupinu na dvě; jednak kyselé aminokyseliny (první dvě), jednak ty, které obsahují karboxylamid (zbývající dvě).
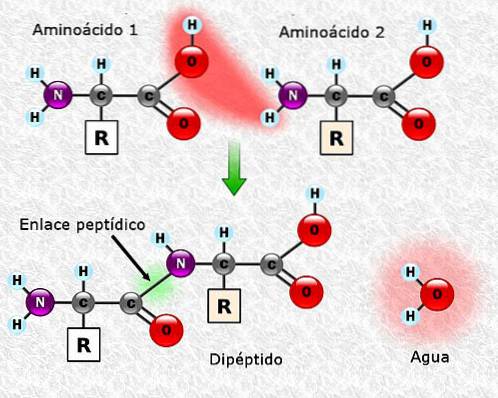
Peptidové vazby
Aminokyseliny mohou být spojeny dohromady pomocí peptidových vazeb. Tyto vazby, také nazývané amidové vazby, se vytvářejí mezi a-aminoskupinou jedné aminokyseliny a a-karboxylovou skupinou druhé. Toto spojení se vytváří se ztrátou molekuly vody.
Spojení mezi dvěma aminokyselinami vede k tvorbě dipeptidu a pokud jsou přidány nové aminokyseliny, mohou se postupně vytvářet tripeptidy, tetrapeptidy atd..
Polypeptidy tvořené malým počtem aminokyselin se obecně nazývají oligopeptidy, a pokud je počet aminokyselin vysoký, pak se jim říká polypeptidy..
Každá aminokyselina, která je přidána k polypeptidovému řetězci, uvolňuje jednu molekulu vody. Část aminokyseliny, která během spojení ztratila H + nebo OH-, se nazývá aminokyselinový zbytek.
Většina z těchto oligopeptidových a polypeptidových řetězců bude mít na jednom konci amino-terminální skupinu (N-terminál) a na druhém konci karboxyl (C-terminál). Kromě toho mohou obsahovat mnoho ionizovatelných skupin mezi postranními řetězci aminokyselinových zbytků, které je tvoří. Z tohoto důvodu jsou považovány za polyampolity.
Sekvence aminokyselin
Každý protein má určitou sekvenci svých aminokyselinových zbytků. Toto pořadí je známé jako primární struktura proteinu..
Každý jednotlivý protein v každém organismu je druhově specifický. To znamená, že myoglobin lidské bytosti je totožný s myoglobinem jiné lidské bytosti, ale má malé rozdíly s myoglobiny jiných savců..
Množství a typy aminokyselin, které protein obsahuje, jsou stejně důležité jako umístění těchto aminokyselin v polypeptidovém řetězci. Abychom porozuměli proteinům, musí biochemici nejprve izolovat a čistit každý konkrétní protein, poté provést analýzu obsahu aminokyselin a nakonec určit jeho sekvenci..
K izolaci a čištění proteinů existují různé metody, mezi něž patří: centrifugace, chromatografie, gelová filtrace, dialýza a ultrafiltrace, jakož i použití vlastností rozpustnosti studovaného proteinu..
Stanovení aminokyselin přítomných v proteinech se provádí po třech krocích. Prvním je rozbití peptidových vazeb hydrolýzou. Následně se ve směsi oddělí různé typy aminokyselin; a nakonec je kvantifikován každý z typů získaných aminokyselin.
K určení primární struktury proteinu lze použít různé metody; ale v současnosti nejpoužívanější je Edmanova metoda, která v zásadě spočívá v opakovaném značení a separaci N-koncové aminokyseliny od zbytku řetězce a v identifikaci každé aminokyseliny uvolněné jednotlivě.
Kódování proteinů
Primární struktura proteinů je kódována v genech organismů. Genetická informace je obsažena v DNA, ale pro její translaci do proteinů musí být nejprve přepsána do molekul mRNA. Každý nukleotidový triplet (kodon) kóduje aminokyselinu.
Protože existuje 64 možných kodonů a při konstrukci proteinů se používá pouze 20 aminokyselin, může být každá aminokyselina kódována více než jedním kodonem. Prakticky všechny živé bytosti používají ke kódování stejných aminokyselin stejné kodony. Genetický kód je proto považován za téměř univerzální jazyk.
V tomto kódu jsou kodony používané ke spuštění a také zastavení translace polypeptidu. Stop kodony nekódují žádnou aminokyselinu, ale zastavují translaci na C-konci řetězce a jsou reprezentovány trojicemi UAA, UAG a UGA..
Na druhé straně kodon AUG normálně funguje jako počáteční signál a také kóduje methionin..
Po translaci mohou proteiny podstoupit určité zpracování nebo modifikaci, jako je zkrácení fragmentací, aby se dosáhlo jejich konečné konfigurace.
Reference
- C.K. Mathews, K.E. van Holde & K.G. Ahern. 2002. Biochemestry. 3th edice. Benjamin / Cummings Publishing Company, Inc..
- Murray, P. Mayes, D.C. Granner & V.W. Rodwell. 1996. Harperova biochemie. Appleton & Lange
- J.M. Berg, J.L. Tymoczko & L. Stryer (nd). Biochemie. 5th edice. W. H. Freeman and Company.
- J. Koolman a K.-H. Roehm (2005). Barevný atlas biochemie. dvand edice. Thieme.
- A. Lehninger (1978). Biochemie. Ediciones Omega, S.A.
- L. Stryer (1995). Biochemie. W.H. Freeman and Company, New York.


Zatím žádné komentáře