
Historie fluoru, vlastnosti, struktura, získávání, rizika, použití
The fluor Jedná se o chemický prvek, který je reprezentován symbolem F a hlavami skupiny 17, ke kterým patří halogeny. Nad ostatními prvky periodické tabulky se odlišuje tím, že je nejreaktivnější a elektronegativní; reaguje s téměř všemi atomy, takže tvoří bezpočet solí a organofluorovaných sloučenin.
Za normálních podmínek je to světle žlutý plyn, který lze zaměnit za žlutozelený. V kapalném stavu, jak je znázorněno na obrázku níže, se jeho žlutá barva ještě více zesiluje, což úplně zmizí, když ztuhne v bodě mrazu..

Přes jeho těkavou povahu je jeho reaktivita taková, že zůstává uvězněn v zemské kůře; zejména ve formě minerálu fluoritu, známého svými fialovými krystaly. Stejně tak jeho reaktivita z něj činí potenciálně nebezpečnou látku; energicky reaguje na vše, čeho se dotkne a hoří v plamenech.
Mnoho z jeho vedlejších produktů však může být neškodných a dokonce prospěšných v závislosti na jejich použití. Například nejoblíbenějším použitím fluoridu přidávaného v iontové nebo minerální formě (jako jsou fluoridové soli) je příprava fluoridových zubních past, které pomáhají chránit zubní sklovinu..
Fluor má tu zvláštnost, že může stabilizovat vysoký počet nebo oxidační stavy pro mnoho dalších prvků. Čím vyšší je počet atomů fluoru, tím reaktivnější je sloučenina (pokud se nejedná o polymer). Stejně tak se zvýší jeho účinky na molekulární matice; pro lepší nebo horší.
Rejstřík článků
- 1 Historie
- 1.1 Použití fluoritu
- 1.2 Příprava kyseliny fluorovodíkové
- 1.3 Izolace
- 1.4 Zájem o fluorid
- 2 Fyzikální a chemické vlastnosti
- 2.1 Vzhled
- 2.2 Atomové číslo (Z)
- 2.3 Atomová hmotnost
- 2.4 Teplota tání
- 2.5 Bod varu
- 2.6 Hustota
- 2.7 Odpařovací teplo
- 2.8 Molární tepelná kapacita
- 2.9 Tlak par
- 2.10 Tepelná vodivost
- 2.11 Magnetické pořadí
- 2.12 Zápach
- 2.13 oxidační čísla
- 2.14 Ionizační energie
- 2.15 Elektronegativita
- 2.16 Oxidační činidlo
- 2.17 Reaktivita
- 3 Struktura a elektronická konfigurace
- 3.1 Diatomová molekula
- 3.2 Tekuté a pevné látky
- 4 Kde najít a získat
- 4.1 Zpracování fluoritu
- 4.2 Elektrolýza fluorovodíku
- 5 izotopů
- 6 Biologická role
- 7 Rizika
- 7.1 Zubní fluoróza
- 7.2 Skeletální fluoróza
- 8 použití
- 8.1 Zubní pasty
- 8.2 Fluoridace vody
- 8.3 Oxidační činidlo
- 8.4 Polymery
- 8.5 Lékárníci
- 8.6 Leptání skla
- 8.7 Obohacování uranu
- 9 Odkazy
Příběh
Použití fluoritu
V roce 1530 německý mineralog Georgius Agricola objevil, že minerál kazivce může být použit při čištění kovů. Fluorspar je jiný název pro fluorit, fluorový minerál, který sestával z fluoridu vápenatého (CaFdva).
Prvek fluor nebyl do té doby objeven a „fluoir“ ve fluoritu pochází z latinského slova „fluere“, což znamená „proudit“; protože to bylo přesně to, co kazivec nebo fluorit udělal s kovy: pomohlo jim to opustit vzorek.
Příprava kyseliny fluorovodíkové
V roce 1764 se Andreasovi Sigismudovi Margraffovi podařilo připravit kyselinu fluorovodíkovou a fluorit zahřát kyselinou sírovou. Skleněné retorty byly roztaveny působením kyseliny, takže sklo bylo nahrazeno kovy.
To je také přičítáno Carl Scheele v roce 1771, příprava kyseliny stejnou metodou, po které následuje Margraff. V roce 1809 francouzský vědec Andre-Marie Ampere navrhl, že kyselina fluorovodíková nebo kyselina fluorovodíková jsou sloučeniny složené z vodíku a nového prvku podobného chloru..
Vědci se pokoušeli izolovat fluorid pomocí kyseliny fluorovodíkové po dlouhou dobu; ale jeho nebezpečnost ztěžovala pokrok v tomto smyslu.
Humphry Davy, Joseph Louis Gay-Lussac a Jacques Thénard měli silné bolesti při vdechování fluorovodíku (kyselina fluorovodíková bez vody a v plynné formě). Vědci Paulin Louyet a Jerome Nickles za podobných okolností zemřeli na otravu.
Edmond Frémy, francouzský výzkumník, se pokusil vytvořit suchou kyselinu fluorovodíkovou, aby se zabránilo toxicitě fluorovodíku okyselením bifluoridu draselného (KHF)dva), ale během elektrolýzy nedošlo k vedení elektrického proudu.
Izolace
V roce 1860 se anglický chemik George Gore pokusil o elektrolýzu suché kyseliny fluorovodíkové a podařilo se mu izolovat malé množství plynného fluoru. Výbuch však nastal, když se vodík a fluor prudce rekombinovaly. Gore připisoval explozi úniku kyslíku..
V roce 1886 se francouzskému chemikovi Henri Moissonovi podařilo poprvé izolovat fluor. Dříve byla Moissonova práce čtyřikrát přerušena těžkou otravou fluorovodíkem, když se pokoušela izolovat prvek..
Moisson byl studentem Frémy a spoléhal na své experimenty při izolaci fluoru. Moisson použil při elektrolýze směs fluoridu draselného a kyseliny fluorovodíkové. Výsledné řešení vedlo elektřinu a plynný fluor shromážděné na anodě; tj. na kladně nabitou elektrodu.
Společnost Moisson použila zařízení odolné proti korozi, ve kterém byly elektrody vyrobeny ze slitiny platiny a iridia. Při elektrolýze použil platinovou nádobu a roztok elektrolytu ochladil na teplotu -31 ° C..
A konečně 26. června 1886 se Henri Moisssonovi podařilo izolovat fluor, což je práce, která mu umožnila získat Nobelovu cenu v roce 1906.
Zájem o fluorid
Zájem o výzkum fluoridů byl na čas ztracen. Vývoj projektu Manhattan na výrobu atomové bomby ji však znovu posílil.
Americká společnost Dupont vyvinula v letech 1930 až 1940 fluorované produkty, jako jsou chlorfluoruhlovodíky (Freon-12), používané jako chladiva; a polytetrafluorethylenový plast, lépe známý pod jménem teflon. Tím se zvýšila produkce a spotřeba fluoridu..
V roce 1986 představil americký chemik Karl O. Christe na konferenci přibližně sto let po izolaci fluoru chemickou metodu pro přípravu fluoru reakcí mezi KdvaMnF6 a SbF5.
Fyzikální a chemické vlastnosti
Vzhled
Fluor je světle žlutý plyn. V kapalném stavu je jasně žlutá. Mezitím může být těleso neprůhledné (alfa) nebo průhledné (beta).
Atomové číslo (Z)
9.
Atomová hmotnost
18 998 u.
Bod tání
-219,67 ° C.
Bod varu
-188,11 ° C.
Hustota
Při pokojové teplotě: 1 696 g / l.
Při teplotě tání (kapalina): 1,505 g / ml.
Odpařovací teplo
6,51 kJ / mol.
Molární tepelná kapacita
31 J / (mol K).
Tlak páry
Při teplotě 58 K má tlak par 986,92 atm.
Tepelná vodivost
0,0277 W / (m K)
Magnetický řád
Diamagnetický
Zápach
Charakteristický štiplavý a štiplavý zápach, zjistitelný i při 20 ppb.
Oxidační čísla
-1, což odpovídá fluoridovému aniontu, F-.
Ionizační energie
-První: 1681 kJ / mol
-Za druhé: 3 374 kJ / mol
-Za třetí: 6 147 KJ / mol
Elektronegativita
3,98 na Paulingově stupnici.
Je to chemický prvek s nejvyššími elektronegativitami; to znamená, že má vysokou afinitu k elektronům atomů, se kterými se váže. Z tohoto důvodu atomy fluoru generují velké dipólové momenty ve specifických oblastech molekuly..
Jeho elektronegativita má také další účinek: atomy k němu vázané ztrácejí tolik elektronové hustoty, že začínají získávat kladný náboj; to je kladné oxidační číslo. Čím více atomů fluoru je ve sloučenině, tím bude mít centrální atom pozitivnější oxidační číslo..
Například v OFdva kyslík má oxidační číslo +2 (Odva+Fdva-); v UF6, Uran má oxidační číslo +6 (U6+F6-); totéž se děje se sírou v SF6 (S.6+F6-); a konečně je tu AgFdva, kde stříbro má dokonce oxidační číslo +2, což je pro něj vzácné.
Proto se elementům podaří účastnit se svými nejpozitivnějšími oxidačními čísly, když tvoří sloučeniny s fluorem..
Oxidační činidlo
Fluor je nejsilnějším oxidačním prvkem, takže žádná látka není schopna jej oxidovat; az tohoto důvodu se v přírodě nenachází zdarma.
Reaktivita
Fluor je schopen kombinovat se všemi ostatními prvky kromě hélia, neonů a argonu. Za normálních teplot také nenapadá měkkou ocel nebo měď. Prudce reaguje s organickými materiály, jako je guma, dřevo a textilie.
Fluor může reagovat s xenonem vzácného plynu za vzniku silného oxidačního činidla xenon difluoridu, XeFdva. Rovněž reaguje s vodíkem za vzniku halogenidu, fluorovodíku, HF. Na druhé straně se fluorovodík rozpouští ve vodě za vzniku slavné kyseliny fluorovodíkové (jako skla).
Kyselost kyselých kyselin, klasifikovaných v rostoucím pořadí, je:
HF < HCl < HBr < HI
Kyselina dusičná reaguje s fluorem za vzniku dusičnanu fluoru, FNO3. Mezitím kyselina chlorovodíková intenzivně reaguje s fluorem za vzniku HF, OFdva a ClF3.
Struktura a elektronická konfigurace

Diatomická molekula

Atom fluoru ve svém základním stavu má sedm valenčních elektronů, které jsou podle elektronické konfigurace na orbitálech 2s a 2p:
[He] 2 sdva 2 str5
Teorie valenčních vazeb (VTE) uvádí, že dva atomy fluoru, F, jsou kovalentně vázány ke každému dokončení svého valenčního oktetu.
To se děje rychle, protože stačí jediný elektron, aby se stal izoelektronickým pro neonový ušlechtilý plyn; a jeho atomy jsou velmi malé a mají velmi silný efektivní jaderný náboj, který snadno vyžaduje elektrony z prostředí.
Molekula Fdva (horní obrázek), má jedinou kovalentní vazbu, F-F. Navzdory své stabilitě ve srovnání s volnými atomy F je to vysoce reaktivní molekula; homonukleární, nepolární a dychtivý po elektronech. Proto je fluor jako Fdva, je to velmi toxický a nebezpečný druh.
Protože Fdva je nepolární, jeho interakce závisí na jeho molekulové hmotnosti a rozptylových silách v Londýně. V určitém okamžiku se elektronický mrak kolem obou atomů F musí deformovat a vzniknout okamžitý dipól, který indukuje další v sousední molekule; aby se navzájem přitahovali pomalu a slabě.
Kapalné a pevné
Molekula Fdva je velmi malý a poměrně rychle se šíří do prostoru. Ve své plynné fázi vykazuje světle žlutou barvu (kterou lze zaměnit za vápennou zelenou). Když teplota klesne na -188 ° C, disperzní síly se stanou účinnějšími a vytvoří molekuly F.dva splynou natolik, aby definovaly kapalinu.
Kapalný fluor (první obrázek) vypadá ještě žlutěji než příslušný plyn. V něm molekuly Fdva jsou si bližší a ve větší míře interagují se světlem. Je zajímavé, že jakmile se zkreslený krychlový krystal fluoru vytvoří při -220 ° C, barva vybledne a zůstane jako průhledná pevná látka..
Nyní, když jsou molekuly F.dva jsou tak blízko (ale bez zastavení jejich molekulárních rotací), zdá se, že jejich elektrony získávají určitou stabilitu, a proto je jejich elektronický skok příliš velký na to, aby světlo dokonce interagovalo s krystalem.
Krystalické fáze
Tento krychlový krystal odpovídá fázi β (nejde o alotrop, protože je stále stejný Fdva). Když teplota klesne ještě dále, až na -228 ° C, prochází tuhý fluor fázovým přechodem; krychlový krystal se stává monoklinickým, fáze α:
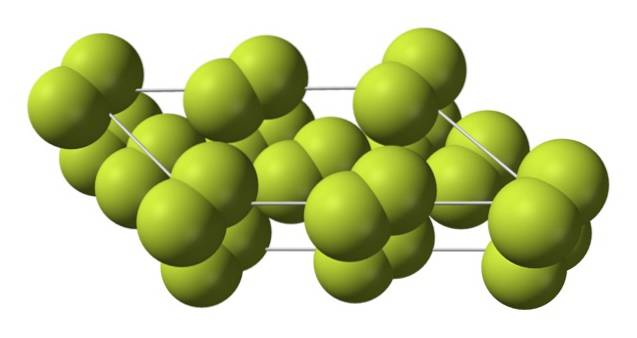
Na rozdíl od β-Fdva, α-Fdva je to neprůhledné a tvrdé. Možná je to proto, že molekuly F.dva už nemají tolik svobody otáčet se ve svých pevných polohách na monoklinických krystalech; kde interagují ve větší míře se světlem, ale bez buzení svých elektronů (což by povrchně vysvětlovalo jejich opacitu).
Krystalová struktura α-Fdva bylo obtížné studovat konvenčními rentgenovými difrakčními metodami, protože přechod z fáze β do fáze α je vysoce exotermický; takže krystal prakticky explodoval, zároveň měl malou interakci s radiací.
Trvalo asi padesát let, než němečtí vědci (Florian Kraus et al.) Úplně rozluštili strukturu α-Fdva přesněji díky technikám neutronové difrakce.
Kde najít a získat
Fluor je na 24. místě mezi nejběžnějšími prvky ve vesmíru. Na Zemi je to však hmotnost 13vo prvek s koncentrací 950 ppm v zemské kůře a koncentrací 1,3 ppm v mořské vodě.
Půdy mají koncentraci fluoridů mezi 150 a 400 ppm a v některých půdách může koncentrace dosáhnout 1 000 ppm. V atmosférickém vzduchu je přítomen v koncentraci 0,6 ppb; ale v některých městech byla zaznamenána až 50 ppb.
Fluor se získává hlavně ze tří minerálů: fluorit nebo fluorospar (CaFdva), fluoroapatit [Ca5(PO4)3F] a kryolit (Na3AlF6).
Zpracování fluoritu
Po shromáždění hornin minerálem fluoritem jsou podrobeny primárnímu a sekundárnímu drcení. Při sekundárním drcení jsou získány velmi malé úlomky hornin.
Fragmenty hornin se poté přenesou do kulového mlýna pro redukci na prášek. Voda a činidla se přidají za vzniku pasty, která se vloží do flotační nádrže. Vzduch se vstřikuje pod tlakem za vzniku bublin, a tak fluorit nakonec plovoucí na vodném povrchu.
Křemičitany a uhličitany se usazují, zatímco se fluorit shromažďuje a odvádí do sušáren..
Jakmile je fluorit získán, reaguje s kyselinou sírovou za vzniku fluorovodíku:
CaFdva + HdvaSW4 => 2 HF + CaSO4
Elektrolýza fluorovodíku
Při výrobě fluoru se s určitými úpravami postupuje podle metody, kterou použil Moisson v roce 1886..
Elektrolýza se provádí ze směsi roztaveného fluoridu draselného a kyseliny fluorovodíkové v molárním poměru 1: 2,0 až 1: 2,2. Teplota roztavené soli je 70 - 130 ° C.
Katoda se skládá ze slitiny Monel nebo oceli a anoda je degrafitový uhlík. Proces výroby fluoru během elektrolýzy lze popsat následovně:
2HF => Hdva + Fdva
K ochlazení komory pro elektrolýzu se používá voda, ale teplota musí být nad teplotou tání elektrolytu, aby nedošlo k tuhnutí. Vodík produkovaný při elektrolýze se shromažďuje na katodě, zatímco fluor na anodě.
Izotopy
Fluor má 18 izotopů 19Jediný stabilní izotop se 100% hojností. The 18F má poločas 109,77 minut a je radioaktivním izotopem fluoru s nejdelším poločasem. The 18F se používá jako zdroj pozitronů.
Biologická role
U savců nebo vyšších rostlin není známa žádná metabolická aktivita fluoru. Některé rostliny a mořské houby však syntetizují monofluoroacetát, jedovatou sloučeninu, kterou používají jako ochranu proti jeho zničení.
Rizika
Nadměrná konzumace fluoridu je spojována s kostní fluorózou u dospělých a zubní fluorózou u dětí, stejně jako se změnami funkce ledvin. Z tohoto důvodu Spojené státy americké veřejné zdravotní služby (PHS) navrhly, že koncentrace fluoridů v pitné vodě by neměla být vyšší než 0,7 mg / l.
Mezitím agentura US Enviromental Protection Agency (EPA) stanovila, že koncentrace fluoridu v pitné vodě by neměla být vyšší než 4 mg / l, aby se zabránilo skeletální fluoróze, při které se fluorid hromadí v kostech. To může vést k oslabení kosti a zlomeninám..
Fluorid je spojován s poškozením příštítných tělísek, poklesem vápníku v kostních strukturách a vysokými koncentracemi vápníku v plazmě.
Mezi změny přisuzované nadbytku fluoridů patří: dentální fluoróza, skeletální fluoróza a poškození příštítných tělísek.
Zubní fluoróza
Zubní fluoróza se vyskytuje s malými pruhy nebo skvrnami na zubní sklovině. Děti do 6 let by neměly používat ústní vody obsahující fluorid..
Skeletální fluoróza
U skeletální fluorózy lze diagnostikovat bolest a poškození kostí i kloubů. Kosti mohou tvrdnout a ztrácet pružnost, což zvyšuje riziko zlomenin.
Aplikace
Zubní pasta

Začneme částí věnovanou použití fluoridů, která je nejznámější: slouží jako součást mnoha zubních past. Toto není jediné použití, kde je oceněn kontrast mezi jeho molekulou Fdva, extrémně jedovatý a nebezpečný a anion F-, které v závislosti na vašem prostředí mohou být prospěšné (i když někdy ne).
Když jíme jídlo, zejména sladkosti, bakterie jej rozkládají zvýšením kyselosti našich slin. Pak přijde bod, kdy je pH dostatečně kyselé, aby degradovalo a demineralizovalo zubní sklovinu; hydroxyapatit se rozpadá.
V tomto procesu však ionty F- komunikovat s Cadva+ za vzniku fluorapatitové matrice; stabilnější a odolnější než hydroxyapatit. Nebo alespoň se jedná o navrhovaný mechanismus vysvětlující působení fluoridového aniontu na zuby. Je pravděpodobné, že bude složitější a bude mít rovnováhu hydroxyapatit-fluorapatit závislou na pH.
Tyto anionty F- Jsou k dispozici v zubních rostlinách ve formě solí; jako: NaF, SnFdva (slavný fluorid cínatý) a NaPOF. Koncentrace F- Musí být nízká (méně než 0,2%), protože jinak má negativní účinky na tělo.
Fluoridace vody
Stejně jako zubní pasta byly do zdrojů pitné vody přidány fluoridové soli k boji proti dutinám u těch, kteří ji pijí. Koncentrace by měla být stále mnohem nižší (0,7 ppm). Tato praxe je však často předmětem nedůvěry a kontroverzí, protože jí byly přisuzovány možné karcinogenní účinky.
Oxidační činidlo
Plyn Fdva chová se jako velmi silné oxidační činidlo. To způsobí, že mnoho sloučenin hoří rychleji, než když jsou vystaveny kyslíku a zdroji tepla. Proto se používá ve směsích raketových paliv, ve kterých může dokonce nahradit ozon.
Polymery
V mnoha použitích nejsou příspěvky fluoru způsobeny Fdva nebo F-, ale přímo na jeho elektronegativní atomy jako součást organické sloučeniny. V podstatě mluvíme o odkazu C-F..
V závislosti na struktuře jsou polymery nebo vlákna s vazbami C-F obvykle hydrofobní, takže nenavlhnou ani neodolávají působení kyseliny fluorovodíkové; Nebo ještě lépe, mohou to být vynikající elektrické izolátory a užitečné materiály, z nichž jsou vyráběny předměty, jako jsou trubky a těsnění. Teflon a nafion jsou příklady těchto fluorovaných polymerů.
Lékárníci
Díky reaktivitě fluoru je jeho použití pro syntézu více sloučenin fluoru, organických nebo anorganických, diskutabilní. V organických látkách, konkrétně v těch s farmakologickými účinky, nahrazení jednoho z jejich heteroatomů atomy F zvyšuje (pozitivně nebo negativně) jejich působení na biologický cíl..
Proto je ve farmaceutickém průmyslu vždy na stole modifikace některých léčiv přidáním atomů fluoru..
Velmi podobné je to s herbicidy a fungicidy. Fluorid v nich může zvýšit jejich účinek a účinnost na hmyzí a plísňové škůdce..
Gravírování skla
Kyselina fluorovodíková se díky své agresivitě se sklem a keramikou používá k gravírování tenkých a jemných kousků těchto materiálů; obvykle určeny pro výrobu mikrokomponentů počítačů nebo pro elektrické žárovky.
Obohacování uranu
Jedním z nejdůležitějších použití elementárního fluoru je pomoci obohatit uran jako 235U. Za tímto účelem jsou uranové minerály rozpuštěny v kyselině fluorovodíkové za vzniku UF4. Tento anorganický fluorid pak reaguje s Fdva, transformovat se tak na UF6 (235PHEW6 Y 238PHEW6).
Následně a pomocí odstředění plynem 235PHEW6 odděluje od 238PHEW6 k pozdější oxidaci a skladování jako jaderné palivo.
Reference
- Shiver & Atkins. (2008). Anorganická chemie. (Čtvrté vydání). Mc Graw Hill.
- Krämer Katrina. (2019). Po 50 letech se struktura zmrazeného fluoru vrátila. Královská společnost chemie. Obnoveno z: chemistryworld.com
- Wikipedia. (2019). Fluor. Obnoveno z: en.wikipedia.org
- Národní centrum pro biotechnologické informace. (2019). Fluor. Databáze PubChem. CID = 24524. Obnoveno z: pubchem.ncbi.nlm.nih.gov
- Dr. Doug Stewart. (2019). Fakta o prvcích fluoru. Chemicool. Obnoveno z: chemicool.com
- Batul Nafisa Baxamusa. (2018, 21. února). Překvapivě běžné použití vysoce reaktivního fluoru. Obnoveno z: sciencestruck.com
- Paola Opazo Sáez. (04. února 2019). Fluorid v zubní pastě: je to dobré nebo špatné pro vaše zdraví? Obnoveno z: nacionfarma.com
- Karl Christe & Stefan Schneider. (8. května 2019). Fluor: chemický prvek. Encyklopedie Britannica. Obnoveno z: britannica.com
- Lenntech B.V. (2019). Periodická tabulka: kyslík. Obnoveno z: lenntech.com
- Gagnon Steve. (s.f.). Prvek fluor. Jefferson Lab. Obnoveno z: education.jlab.org
- Lékařský a redakční tým American Cancer Society. (2015, 28. července). Fluoridace vody a riziko rakoviny. Obnoveno z: cancer.org



Zatím žádné komentáře