
Struktura fluoridu hořečnatého, vlastnosti, syntéza, použití
The fluorid hořečnatý je to bezbarvá anorganická sůl, jejíž chemický vzorec je MgF₂. V přírodě se vyskytuje jako minerál sellait. Má velmi vysokou teplotu tání a je velmi špatně rozpustný ve vodě. Je relativně inertní, protože například jeho reakce s kyselinou sírovou je pomalá a neúplná a odolává hydrolýze s kyselinou fluorovodíkovou (HF) až do 750 ° C..
Je to sloučenina málo ovlivněná radiací s vysokou energií. Kromě toho má nízký index lomu, vysokou odolnost proti korozi, dobrou tepelnou stabilitu, významnou tvrdost a vynikající vlastnosti přenosu viditelného, UV (ultrafialového) a IR (infračerveného) světla..
Díky těmto vlastnostem má vynikající výkon v optickém poli a kromě toho z něj činí užitečný materiál jako nosič katalyzátoru, potahový prvek, antireflexní čočky a okna pro infračervený přenos, mimo jiné..
Rejstřík článků
- 1 Struktura
- 2 Vlastnosti
- 3 Syntéza a příprava
- 4 použití
- 4.1 Optika
- 4.2 Katalýza nebo zrychlení reakcí
- 4.3 Jiná použití
- 5 Reference
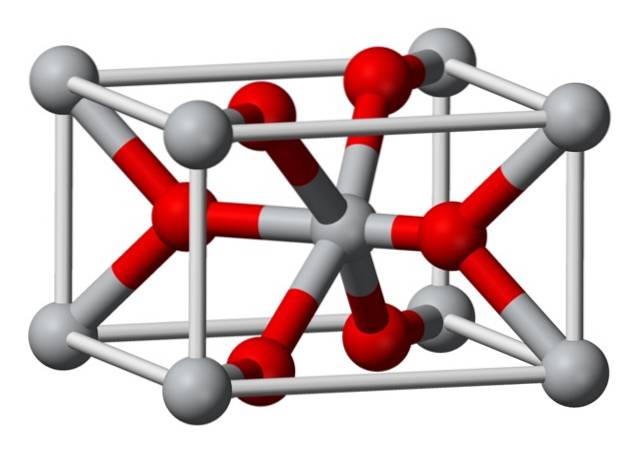
Struktura
Krystalická struktura chemicky připraveného fluoridu hořečnatého je stejného typu jako přírodní minerál sellait. Krystalizuje v dipyramidové třídě tetragonálního systému.
Ionty hořčíku (Mg2 +) jsou umístěny ve středovém tetragonálním mřížkovém prostoru, zatímco fluoridové ionty (F-) se nacházejí ve stejné rovině jako a spojené s jejich sousedy Mg2 +, seskupené do dvojic. Vzdálenost mezi ionty Mg2 + a F- je 2,07 Å (angstromy) (2,07 × 10-10 m).
Jeho krystalová koordinace je 6: 3. To znamená, že každý iont Mg2 + je obklopen 6 ionty F a každý F-iont je zase obklopen 3 ionty Mg2 + 5..
Struktura je velmi podobná struktuře minerálu rutilu, což je přírodní forma oxidu titaničitého (TiO2), se kterou má několik společných krystalografických vlastností..
Během jeho výroby se fluorid hořečnatý nevysráží jako amorfní pevná látka, protože ionty Mg2 + a F- nemají tendenci vytvářet v roztoku polymerní komplexy..
Vlastnosti
Je zajímavé, že fluorid hořečnatý je dvojlomný materiál. Jedná se o optickou vlastnost, která umožňuje rozdělení dopadajícího světelného paprsku na dva samostatné paprsky, které se šíří různými rychlostmi a vlnovými délkami..
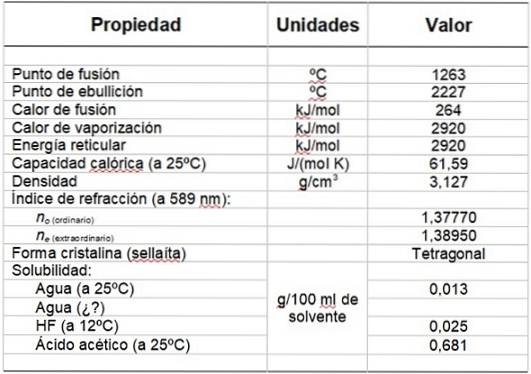
Tabulka 1 ukazuje některé z jeho vlastností.
Tabulka 1. Fyzikální a chemické vlastnosti fluoridu hořečnatého.
Syntéza a příprava
Může být připraven různými způsoby, včetně následujících:
1 - Reakcí mezi oxidem hořečnatým (MgO) nebo uhličitanem hořečnatým (MgCO3) s kyselinou fluorovodíkovou (HF) 2:
MgO + 2 HF MgF2 + H20
MgCO3 + 2 HF MgF2 + CO2 + H20
2-Reakcí mezi uhličitanem hořečnatým a bifluoridem amonným (NH4HF2), a to jak v pevném stavu, při teplotě mezi 150 a 400 ° C2:
150-400 ° C
MgCO3 + NH4HF2 MgF2 + NH3 + CO2 + H20
3 - Zahřívání vodného roztoku uhličitanu hořečnatého a fluoridu amonného (NH4F) v přítomnosti hydroxidu amonného (NH4OH) při 60 ° C 2:
60 ° C, NH40H
MgCO3 + 3 NH4F NH4MgF3 + (NH4) 2CO3
Výsledná sraženina fluoridu hořečnato-amonného (NH4MgF3) se poté zahřívá 4 hodiny na 620 ° C, čímž se získá fluorid hořečnatý:
620 ° C
NH4MgF3 MgF2 + NH3 + HF
4-Jako vedlejší produkt při získávání berylia (Be) a uranu (U). Fluorid požadovaného prvku se zahřívá kovovým hořčíkem v kelímku potaženém MgF2 2:
BeF2 + Mg Be + MgF2
5-Chlorid hořečnatý (MgCl2) s fluoridem amonným (NH4F) ve vodném roztoku při teplotě místnosti 3:
25 ° C, H20
MgCl2 + 2 NH4F MgF2 + 2NH4Cl
Protože způsoby přípravy MgF2 jsou nákladné, objevují se pokusy o jeho ekonomičtější získání, mezi nimiž vyniká způsob jeho výroby vycházející z mořské vody..
To je charakterizováno přidáním dostatečného množství fluoridových iontů (F-) do mořské vody, která má hojnou koncentraci iontů hořčíku (Mg2 +), což podporuje srážení MgF2..
Optické krystaly fluoridu hořečnatého se získávají lisováním za horka vysoce kvalitního prášku MgF2, získaného například metodou NH4HF2.
Existuje mnoho technik pro přípravu materiálů obsahujících fluorid hořečnatý, jako je růst monokrystalů, slinování (lisování do formy nebo tvarování) bez tlaku, lisování za tepla a mikrovlnné slinování..
Aplikace
Optika
Krystaly MgF2 jsou vhodné pro optické aplikace, protože jsou průhledné z UV oblasti do střední IR oblasti 2.10.
Jako inertní film se používá ke změně vlastností přenosu optických a elektronických materiálů. Jednou z hlavních aplikací je optika VUV pro technologii průzkumu vesmíru.
Díky své dvojlomné vlastnosti je tento materiál užitečný v polarizační optice, v oknech a hranolech Excimer Laser (typ ultrafialového laseru používaný v oční chirurgii)..
Je třeba poznamenat, že fluorid hořečnatý používaný při výrobě tenkovrstvých optických materiálů nesmí obsahovat nečistoty ani sloučeniny, které jsou zdrojem oxidů, jako je voda (H2O), hydroxidové ionty (OH-), uhličitanové ionty (CO3 = ), síranové ionty (SO4 =) a podobně 12.
Katalýza nebo zrychlení reakcí
MgF2 se úspěšně používá jako katalyzátorový nosič pro reakci eliminace chloru a přidání vodíku v CFC (chlorfluoruhlovodíky), známých chladivech a hnacích plynech aerosolu a je odpovědný za poškození ozonové vrstvy atmosféry.
Výsledné sloučeniny, HFC (fluorované uhlovodíky) a HCFC (hydrochlorofluorované uhlovodíky), nepůsobí tento škodlivý účinek na atmosféru 5.
Bylo také užitečné jako nosič katalyzátoru pro hydrodesulfurizaci (odstranění síry) organických sloučenin..
Jiná použití
Materiály generované interkalací grafitu, fluoru a MgF2 mají vysokou elektrickou vodivost, a proto byly navrženy pro použití v katodách a jako elektrovodivé materiály..
Eutektikum tvořené NaF a MgF2 má vlastnosti akumulace energie ve formě latentního tepla, a proto se uvažuje o jeho použití v solárních energetických systémech..
V oblasti biochemie se fluorid hořečnatý spolu s dalšími fluoridy kovů používá k inhibici reakcí přenosu fosforylu v enzymech.
Nedávno byly nanočástice MgF2 úspěšně testovány jako vektory pro dodávání léčiv v nemocných buňkách pro léčbu rakoviny..
Reference
- Buckley, H.E. a Vernon, W.S. (1925) XCIV. Krystalová struktura fluoridu hořečnatého. Philosophical Magazine Series 6, 49: 293, 945-951.
- Kirk-Othmer (1994). Encyclopedia of Chemical Technology, svazek 11, páté vydání, John Wiley & Sons. ISBN 0-471-52680-0 (v.11).
- Peng, Minhong; Cao, Weiping; a Song, Jinhong. (2015). Příprava průsvitné keramiky MgF2 slinováním za horka. Journal of Wuhan University of Technology-Mater: Sci. Ed. Vol. 30 No. 4.
- Непоклонов, И.С. (2011). Fluorid hořečnatý. Zdroj: Vlastní práce.
- Wojciechowska, Maria; Zielinski, Michal; a Pietrowski, Mariusz. (2003). MgF2 jako nekonvenční nosič katalyzátoru. Journal of Fluorine Chemistry, 120 (2003) 1-11.
- Korth Kristalle GmbH. (2019). Fluorid hořečnatý (MgF2). Citováno 2019-07-12 na: korth.de
- Sevonkaev, Igor a Matijevic, Egon. (2009). Tvorba částic fluoridu hořečnatého různých morfologií. Langmuir 2009, 25 (18), 10534-10539.
- Непоклонов, И.С. (2013). Fluorid hořečnatý. Zdroj: Vlastní práce.
- Tao Qin, Peng Zhang a Weiwei Qin. (2017). Nová metoda syntézy levných kuliček fluoridu hořečnatého z mořské vody. Ceramics International 43 (2017) 14481-14483.
- Ullmann's Encyclopedia of Industrial Chemistry (1996), páté vydání. Svazek A11. VCH Verlagsgesellschaft mbH. New York. ISBN 0-89573-161-4.
- NASA (2013). Inženýři kontrolující primární zrcátko Hubbleova kosmického dalekohledu 8109563. Zdroj: mix.msfc.nasa.gov



Zatím žádné komentáře