
Kohezní síla

Co jsou to kohezní síly?
The kohezní síly jsou to mezimolekulární síly přitažlivosti, které drží molekuly pohromadě. V závislosti na intenzitě kohezních sil je látka v pevném, kapalném nebo plynném stavu. Hodnota kohezních sil je vnitřní vlastností každé látky.
Tato vlastnost souvisí s tvarem a strukturou molekul každé látky. Důležitou charakteristikou kohezních sil je, že se s rostoucí vzdáleností rychle snižují. Potom se kohezní síly nazývají atraktivní síly, které se vyskytují mezi molekulami stejné látky.
The odpudivé síly jsou ty, které jsou výsledkem kinetické energie (energie způsobené pohybem) částic. Tato energie způsobuje, že molekuly jsou neustále v pohybu. Intenzita tohoto pohybu je přímo úměrná teplotě, při které se látka nachází..
K vyvolání změny skupenství látky je nutné zvýšit její teplotu přenosem tepla. To způsobí, že se odpudivé síly látky zvýší, což v případě může skončit za předpokladu, že dojde ke změně stavu..
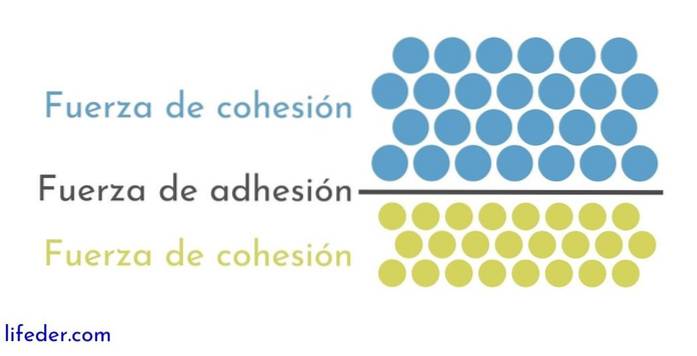
Na druhou stranu je důležité a nutné rozlišovat mezi soudržnost a přilnavost:
- Soudržnost je způsobena přitažlivými silami, které se vyskytují mezi sousedními částicemi stejné látky.
- Adheze je výsledkem interakce, ke které dochází mezi povrchy různých látek nebo těl.
Zdá se, že tyto dvě síly souvisejí s různými fyzikálními jevy, které ovlivňují kapaliny, takže je důležité dobře porozumět oběma..
Kohezní síly v pevných látkách, kapalinách a plynech

V pevných látkách
Obecně platí, že v pevných látkách jsou kohezní síly velmi vysoké a vyskytují se intenzivně ve třech směrech vesmíru..
Tímto způsobem, pokud je na pevné těleso aplikována vnější síla, dochází pouze k malým posunům molekul vůči sobě navzájem..
Kromě toho, když vnější síla zmizí, jsou kohezní síly dostatečně silné, aby vrátily molekuly do jejich původní polohy, čímž se obnoví poloha před použitím síly..
V tekutinách
Naopak v kapalinách jsou kohezní síly vysoké pouze ve dvou prostorových směrech, zatímco mezi vrstvami tekutin jsou velmi slabé..
Když tedy na kapalinu působí síla v tangenciálním směru, tato síla rozbíjí slabé vazby mezi vrstvami. To způsobí, že vrstvy kapaliny klouzají po sobě..
Později, když je aplikace síly ukončena, kohezní síly nemají dostatečnou sílu, aby vrátily molekuly kapaliny do jejich původní polohy..
Kromě toho se soudržnost v kapalinách odráží také v povrchovém napětí způsobeném nevyváženou silou směřující do vnitřku kapaliny, působící na povrchové molekuly..
Podobně je také pozorována soudržnost, když dojde k přechodu z kapalného stavu do pevného stavu, v důsledku účinku komprese molekul kapaliny..
V plynech
V plynech jsou kohezní síly zanedbatelné. Tímto způsobem jsou molekuly plynu v neustálém pohybu, protože v takovém případě je kohezní síly nedokáží udržet spojené..
Z tohoto důvodu lze v plynech kohezní síly ocenit pouze tehdy, když dochází ke zkapalňovacímu procesu, ke kterému dochází, když jsou stlačeny plynné molekuly a přitažlivé síly jsou dostatečně silné, aby vyvolaly přechod stavu..
Příklady kohezních sil
Kohezní síly se často spojují s adhezními silami, aby vznikly určité fyzikální a chemické jevy.
Například kohezní síly spolu s adhezními silami vysvětlují některé z nejběžnějších jevů, které se vyskytují v kapalinách; je případ menisku, povrchového napětí a kapilarity.
Proto je v případě kapalin nutné rozlišovat mezi kohezními silami, ke kterým dochází mezi molekulami stejné kapaliny; a adheze, ke kterým dochází mezi molekulami kapaliny a pevné látky.
Povrchové napětí

Povrchové napětí je síla, která vzniká tangenciálně a na jednotku délky na okraji volného povrchu kapaliny, která je v rovnováze. Tato síla smršťuje povrch kapaliny.
Nakonec dochází k povrchovému napětí, protože síly v molekulách kapaliny se na povrchu kapaliny liší od sil uvnitř..
Meniskus
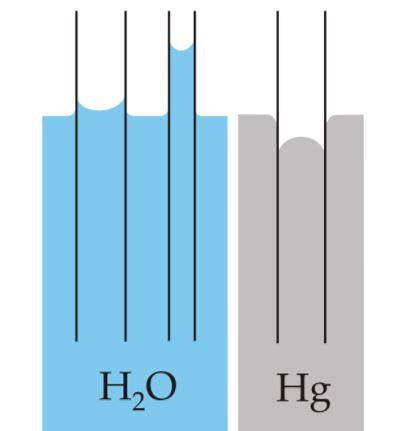
Meniskus je zakřivení, které se vytváří na povrchu tekutin, když jsou uzavřeny v nádobě. Tato křivka je vytvořena účinkem, který má povrch nádoby, která ji obsahuje, na kapalinu..
Křivka může být konvexní nebo konkávní, v závislosti na tom, zda je síla mezi molekulami kapaliny a molekulami nádoby atraktivní - jako je tomu u vody a skla - nebo jsou odpudivé, jako je tomu mezi rtutí a sklem..
Kapilarita

Kapilarita je vlastnost tekutin, která jim umožňuje stoupat nebo sestupovat kapilární trubicí. Je to vlastnost, která částečně umožňuje vzestup vody uvnitř rostlin.
Kapalina stoupá nahoru kapilární trubicí, když jsou síly soudržnosti menší než síly adheze mezi kapalinou a stěnami trubice. Tímto způsobem bude kapalina stoupat, dokud se hodnota povrchového napětí nebude rovnat hmotnosti kapaliny obsažené v kapilární trubici..
Naopak, pokud jsou kohezní síly větší než adhezní síly, povrchové napětí sníží kapalinu a tvar jejího povrchu bude konvexní..
Reference
- Soudržnost (chemie) (n.d.). Na Wikipedii. Obnoveno z en.wikipedia.org.
- Povrchové napětí (n.d.). Na Wikipedii. Obnoveno z en.wikipedia.org.
- Kapilarita (n.d.). Na Wikipedii. Obnoveno z es.wikipedia.org.
- Ira N. Levine; "Fyzikochemie", svazek 1; Páté vydání; 2004; Mc Graw Hillm.
- Moore, John W.; Stanitski, Conrad L.; Jurs, Peter C. (2005). Chemistry: The Molecular Science. Belmont, CA: Brooks / Cole.
- White, Harvey E. (1948). Moderní vysokoškolská fyzika. van Nostrand.



Zatím žádné komentáře