
Vlastnosti, konfigurace, reakce, použití ušlechtilých plynů

The vzácné plyny Jedná se o sadu prvků, které se nacházejí ve skupině 18 periodické tabulky. V průběhu let se jim také říkalo vzácné nebo inertní plyny, které jsou nepřesné; některé z nich jsou velmi hojné vně i uvnitř planety Země a jsou také schopné za extrémních podmínek reagovat.
Jeho sedm prvků tvoří pravděpodobně nejunikátnější skupinu v periodické tabulce, jejíž vlastnosti a nízká reaktivita jsou stejně působivé jako vlastnosti ušlechtilých kovů. Mezi nimi přehlídka nejinertnější prvek (neon), druhý nejhojnější z vesmíru (hélium) a nejtěžší a nejstabilnější (oganeson).

Ušlechtilé plyny jsou nejchladnějšími látkami v přírodě; odolávat velmi nízkým teplotám před kondenzací. Ještě obtížnější je jeho zmrazení, protože jeho mezimolekulární síly založené na Londýnském rozptylu a polarizovatelnost jeho atomů jsou příliš slabé na to, aby je sotva udržovaly soudržné v krystalu..
Vzhledem k jejich nízké reaktivitě jsou to relativně bezpečné plyny pro skladování a nepředstavují příliš mnoho rizik. Mohou však vytlačovat kyslík z plic a při nadměrném vdechování způsobit udušení. Na druhé straně dva z jejích členů jsou vysoce radioaktivní prvky, a proto jsou zdraví škodlivé..
Nízká reaktivita vzácných plynů se také používá k zajištění reakcí v inertní atmosféře; tak, aby žádné činidlo nebo produkt nehrozilo riziko oxidace a ovlivnění výkonu syntézy. To také upřednostňuje procesy svařování elektrickým obloukem..
Na druhou stranu ve svých kapalných skupinách jsou to vynikající kryogenní chladiva, která zaručují nejnižší teploty, nezbytné pro správný provoz vysoce energetického zařízení nebo pro to, aby některé materiály dosáhly stavu supravodivosti.
Rejstřík článků
- 1 Charakteristika vzácných plynů
- 2 Sedm vzácných plynů
- 3 Elektronická konfigurace
- 4 Polarizovatelnost
- 5 Reakce
- 5.1 Helium a neon
- 5.2 Argon a krypton
- 5.3 Xenon a radon
- 6 Výroba
- 6.1 Zkapalňování vzduchu
- 6.2 Destilace zemního plynu a radioaktivních nerostů
- 7 Nebezpečí
- 8 použití
- 8.1 Průmysl
- 8.2 Balóny a dýchací nádrže
- 8.3 Lék
- 8.4 Ostatní
- 9 Odkazy
Vlastnosti ušlechtilého plynu
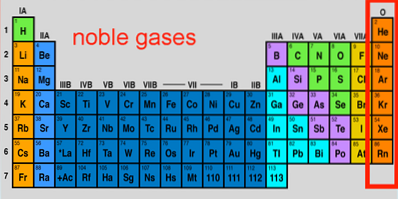
Možná jsou vzácné plyny prvky, které sdílejí nejvíce společných kvalit, fyzických i chemických. Jeho hlavní vlastnosti jsou:
- Všechny jsou bezbarvé, bez zápachu a bez chuti; ale když jsou uzavřeny v ampulích při nízkém tlaku a dostanou elektrický šok, ionizují a vydávají barevná světla (horní obrázek).
- Každý vzácný plyn má své vlastní světlo a spektrum.
- Jsou to monatomické druhy, jediné v periodické tabulce, které mohou existovat v příslušných fyzikálních stavech bez účasti chemických vazeb (protože kovy jsou spojeny kovovými vazbami). Proto jsou ideální pro studium vlastností plynů, protože se velmi dobře přizpůsobují sférickému modelu ideálního plynu..
- Obvykle se jedná o prvky s nejnižšími teplotami tání a varu; natolik, že hélium nemůže ani krystalizovat při absolutní nule bez zvýšení tlaku.
- Ze všech prvků jsou nejméně reaktivní, dokonce méně než ušlechtilé kovy.
- Jejich ionizační energie jsou nejvyšší, stejně jako jejich elektronegativity, za předpokladu, že tvoří čistě kovalentní vazby..
- Jeho atomové poloměry jsou také nejmenší, protože jsou na správných koncích každé periody..
Sedm vzácných plynů
Sedm vzácných plynů sestupuje seshora dolů seskupením 18 periodické tabulky:
-Helium, He
-Neon, Ne

-Argon, Ar
-Krypton, Kr
-Xenon, Xe

-Radon, Rn
-Oganeson, Og
Všechny z nich, s výjimkou nestabilního a umělého oganesonu, byly studovány z hlediska jejich fyzikálních a chemických vlastností. Oganeson kvůli své velké atomové hmotnosti není považován ani za plyn, ale za ušlechtilou kapalinu nebo pevnou látku. O radonu je málo známo kvůli jeho radioaktivitě ve vztahu k heliu nebo argonu.
Elektronická konfigurace
O ušlechtilých plynech se říká, že mají svou valenční skořápku plně naplněnou. Tolik, že jejich elektronické konfigurace se používají ke zjednodušení ostatních prvků pomocí jejich symbolů uzavřených v hranatých závorkách ([He], [Ne], [Ar] atd.). Jeho elektronické konfigurace jsou:
-Helium: 1 sdva, [He] (2 elektrony)
-Neon: 1 sdva2 sdva2 str6, [Ne] (10 elektronů)
-Argon: 1 sdva2 sdva2 str63 sdva3p6, [Ar] (18 elektronů)
-Krypton: 1 sdva2 sdva2 str63 sdva3p63d104 sdva4p6, [Kr] (36 elektronů)
-Xenon: 1 sdva2 sdva2 str63 sdva3p63d104 sdva4p64d105 sdva5 str6, [Xe] (54 elektronů)
-Radon: 1 sdva2 sdva2 str63 sdva3p63d104 sdva4p64d104f145 sdva5 str65 d106 sdva6p6, [Rn] (86 elektronů)
Důležité je nezapomenout na ně, ale podrobně popsat, že končí nsdvanp6: valenční oktet. Podobně se oceňuje, že jeho atomy mají mnoho elektronů, které se díky velké účinné jaderné síle nacházejí v menším objemu ve srovnání s ostatními prvky; to znamená, že jejich atomové poloměry jsou menší.
Proto jejich elektronicky husté atomové poloměry vykazují chemickou charakteristiku, kterou sdílejí všechny vzácné plyny: je těžké je polarizovat..
Polarizovatelnost
Vzácné plyny si lze představit jako koule elektronových mraků. Při sestupu skupinou 18 se zvětšují její poloměry a stejným způsobem vzdálenost, která odděluje jádro od valenčních elektronů (nsdvanp6).
Tyto elektrony, když pociťují méně atraktivní sílu na části jádra, se mohou pohybovat volněji; sféry se snáze deformují, tím jsou objemnější. V důsledku těchto pohybů se objevují oblasti s nízkou a vysokou hustotou elektronů: póly δ + a δ-.
Když je atom vzácného plynu polarizován, stává se okamžitým dipólem schopným indukovat další sousednímu atomu; to znamená, že čelíme disperzním silám Londýna.
Proto se mezimolekulární síly zvyšují z helia na radon, což se odráží v jejich rostoucích bodech varu; a nejen to, ale také se zvyšuje jejich reaktivita.
Jak se atomy stávají více polarizovanými, existuje větší možnost, že se jejich valenční elektrony účastní chemických reakcí, po nichž se generují sloučeniny vzácných plynů..
Reakce
Hélium a neon
Mezi vzácnými plyny jsou nejméně reaktivní hélium a neon. Neon je ve skutečnosti nejinertnějším prvkem ze všech, i když jeho elektronegativita (z tvorby kovalentních vazeb) převyšuje fluor.
Žádná z jejích sloučenin není známa za suchozemských podmínek; V Kosmu je však existence molekulárního iontu HeH docela pravděpodobná+. Podobně, když jsou elektronicky vzrušeni, jsou schopni interakce s plynnými atomy a tvorby krátkodobých neutrálních molekul nazývaných excimery; jako HeNe, CsNe a Nedva.
Na druhou stranu, ačkoli nejsou formálně považovány za sloučeniny, mohou atomy He a Ne vést k molekulám Van der Walls; tj. sloučeniny, které drží „pohromadě“ jednoduše disperzní síly. Například: Ag3On, HeCO, HeIdva, CF4Ne, Ne3Cldva a NeBeCO3.
Podobně takové molekuly Van der Walls mohou existovat díky slabým iontem indukovaným dipólovým interakcím; například: Na+mám8, Rb+On, Cu+Ne3 a Cu+Ne12. Všimněte si, že je dokonce možné, aby se z těchto molekul staly aglomeráty atomů: shluky.
A konečně mohou být atomy He a Ne „uvězněny“ nebo interkalovány v endohedrálních komplexech fullerenů nebo klatrátů, aniž by reagovaly; například: [chráněno e-mailem]60, (Ndva)6Ne7, On (HdvaNEBO)6 a Ne • NH4Fe (HCOO)3.
Argon a krypton
Vzácné plyny argon a krypton, protože jsou více polarizovatelné, mají tendenci představovat více „sloučenin“ než hélium a neon. Část z nich je však stabilnější a charakterizovatelnější, protože mají delší životnost. Mezi některé z nich patří HArF a molekulární iont ArH+, přítomný v mlhovinách působením kosmického záření.
Z kryptonu začíná možnost získávat sloučeniny v extrémních, ale udržitelných podmínkách. Tento plyn reaguje s fluorem podle následující chemické rovnice:
Kr + Fdva → KrFdva
Všimněte si, že krypton získává oxidační číslo +2 (Krdva+) díky fluoridu. KrFdva ve skutečnosti může být syntetizován v obchodovatelném množství jako oxidační a fluorační činidlo.
Argon a krypton mohou vytvořit široký repertoár klatrátů, endohedrálních komplexů, molekul Van der Wallse a některých sloučenin, které čekají na objev po své předpokládané existenci..
Xenon a radon
Xenon je mezi vzácnými plyny králem reaktivity. Tvoří skutečně stabilní, obchodovatelné a charakterizovatelné sloučeniny. Jeho reaktivita se ve skutečnosti podobá reaktivitě kyslíku za vhodných podmínek..
Jeho první syntetizovaná sloučenina byla „XePtF6“, V roce 1962 Neil Bartlett. Tato sůl podle literatury ve skutečnosti sestávala ze složité směsi dalších fluorovaných solí xenonu a platiny.
To však bylo více než dost na prokázání afinity mezi xenonem a fluorem. Mezi některé z těchto sloučenin patří: XeFdva, XeF4, XeF6 a [XeF]+[PtF5]-. Když XeF6 rozpouští se ve vodě, vytváří oxid:
XeF6 + 3 HdvaO → XeO3 + 6 HF
Toto XeO3 může pocházet z druhů známých jako xenatos (HXeO4-) nebo kyselina xenová (H.dvaXeO4). Xenáty nepřiměřené vůči perxenátům (XeO64-); a pokud je médium poté okyseleno, v kyselině peroxenové (H4XeO6), který je dehydratován na xenon tetroxid (XeO4):
H4XeO6 → 2 HdvaO + XeO4
Radon by měl být nejreaktivnějším z drahých plynů; Je však tak radioaktivní, že má sotva čas reagovat, než se rozpadne. Jedinými sloučeninami, které byly plně syntetizovány, je jeho fluorid (RnFdva) a oxid (RnO3).
Výroba
Zkapalňování vzduchu
Vzácné plyny se ve vesmíru hojněji vyskytují, když sestupujeme skupinou 18. V atmosféře je však hélium vzácné, protože gravitační pole Země jej na rozdíl od jiných plynů nedokáže udržet. Proto nebyl detekován ve vzduchu, ale na Slunci.
Na druhou stranu ve vzduchu existují značná množství argonu pocházejícího z radioaktivního rozpadu radioizotopu 40K. Vzduch je nejdůležitějším přirozeným zdrojem argonu, neonu, kryptonu a xenonu na planetě.
K jejich výrobě musí být vzduch nejprve zkapalněn, aby kondenzoval na kapalinu. Poté tato kapalina prochází frakční destilací, čímž se odděluje každá ze složek její směsi (Ndva, NEBOdva, COdva, Ar atd.).
V závislosti na tom, jak nízká musí být teplota a množství plynu, se jeho ceny zvyšují a řadí xenon k nejdražším, zatímco hélium k nejlevnějším..
Destilace zemního plynu a radioaktivních nerostů
Helium se získává z jiné frakční destilace; ale ne ze vzduchu, ale ze zemního plynu obohaceného o helium díky uvolňování alfa částic z radioaktivních minerálů thoria a uranu.
Podobně se radon „rodí“ z radioaktivního rozpadu radia v příslušných minerálech; ale vzhledem k jejich nižšímu množství a krátkému poločasu atomů Rn je jejich množství směšné ve srovnání s jejich kongenery (jinými vzácnými plyny).
A konečně, oganeson je vysoce radioaktivní, ultramasický, člověkem vyrobený ušlechtilý „plyn“, který může existovat pouze krátce za kontrolovaných podmínek v laboratoři..
Nebezpečí
Hlavní riziko vzácných plynů spočívá v tom, že omezují použití kyslíku člověkem, zejména když se vytváří atmosféra s vysokou koncentrací těchto plynů. Proto se nedoporučuje nadměrné vdechování..
Ve Spojených státech byla v půdách bohatých na uran zjištěna vysoká koncentrace radonu, což by vzhledem k jeho radioaktivním vlastnostem mohlo představovat zdravotní riziko.
Aplikace
Průmysl
Helium a argon se používají k vytvoření inertní atmosféry pro ochranu během svařování a řezání. Kromě toho se používají při výrobě křemíkových polovodičů. Hélium se používá jako plnící plyn v teploměrech.
Argon se v kombinaci s dusíkem používá při výrobě žárovek. Krypton smíchaný s halogeny, jako je brom a jod, se používá ve výbojkách. Neon se používá ve světelných znameních, ve směsi s fosfory a jinými plyny k zabarvení jeho červené barvy.
Xenon se používá v obloukových lampách, které vyzařují světlo podobné dennímu světlu a které se používají v automobilových světlometech a projektorech. Vzácné plyny se mísí s halogeny za vzniku ArF, KrF nebo XeCl, které se používají při výrobě excimerových laserů.
Tento typ laseru produkuje ultrafialové světlo krátkých vln, které produkuje vysoce přesné obrazy a používá se při výrobě integrovaných obvodů. Hélium a neon se používají jako kryogenní plyny chladiva.
Balóny a dýchací nádrže
Hélium se používá jako náhrada dusíku ve směsi dýchacích plynů kvůli jeho nízké rozpustnosti v těle. Tím se zabrání tvorbě bublin během dekompresní fáze během výstupu a navíc se eliminuje dusíková narkóza.
Helium nahradilo vodík jako plyn, který umožňuje zvedání vzducholodí a horkovzdušných balónů, protože jde o lehký a nehořlavý plyn..
Lék
Hélium se používá při výrobě supravodivých magnetů používaných v zařízeních pro nukleární magnetickou rezonanci: víceúčelový nástroj v medicíně.
Krypton se používá v halogenových žárovkách používaných při laserové operaci očí a angioplastice. Helium se používá k usnadnění dýchání u astmatických pacientů.
Xenon se používá jako anestetikum kvůli své vysoké rozpustnosti v tucích a považuje se za anestetikum budoucnosti. Xenon se také používá při lékařském zobrazování plic.
Radon, radioaktivní vzácný plyn, se používá při radiační terapii u některých typů rakoviny.
Ostatní
Argon se používá při syntéze sloučenin nahrazujících dusík jako inertní atmosféru. Hélium se používá jako nosný plyn v plynové chromatografii, stejně jako v Geigerových počítačích pro měření záření.
Reference
- Shiver & Atkins. (2008). Anorganická chemie. (Čtvrté vydání). Mc Graw Hill.
- Whitten, Davis, Peck a Stanley. (2008). Chemie. (8. vydání). Učení CENGAGE.
- Helmenstine, Anne Marie, Ph.D. (06.06.2019). Vlastnosti, použití a zdroje ušlechtilých plynů. Obnoveno z: thoughtco.com
- Wikipedia. (2019). Vznešený plyn. Obnoveno z: en.wikipedia.org
- Philip Ball. (18. ledna 2012). Nemožná chemie: Nucení působení vzácných plynů. Obnoveno z: newscientist.com
- Profesorka Patricia Shapleyová. (2011). Chemie ušlechtilých plynů. Obnoveno z: butane.chem.uiuc.edu
- Gary J. Schrobilgen. (28. února 2019). Vznešený plyn. Encyklopedie Britannica. Obnoveno z: britannica.com



Zatím žádné komentáře