
Vlastnosti plynů, chování, tvar, příklady

The plyny Jsou to všechny ty látky nebo sloučeniny, jejichž stavy agregace jsou slabé a rozptýlené, a zároveň velmi závisí na tlakových a teplotních podmínkách, které je řídí. Po plazmě jsou možná druhou nejhojnější formou hmoty v celém vesmíru..
Na Zemi tvoří plyny vrstvy atmosféry, od exosféry po troposféru a vzduch, který dýcháme. I když je plyn neviditelný, když je rozptýlen do velkých prostor, jako je obloha, je detekován pohybem mraků, otáčením lopatek mlýna nebo výpary vydechovanými z našich úst v chladném podnebí..

Podobně, pokud jde o negativní environmentální aspekty, je to pozorováno u černého kouře z výfukového potrubí vozidel, v kouřových sloupech věží umístěných v továrnách nebo v kouři vzniklém při hoření lesa.
Rovněž čelíte plynným jevům, když vidíte výpary, které vycházejí ze stok, v pramenech bažin a hřbitovů, v bublajících nádržích na ryby, v heliových balónech vypouštěných do nebe, v kyslíku uvolněném rostlinami v důsledku jejich fotosyntézy a dokonce v říhání a plynatosti.
Kdekoli jsou plyny pozorovány, znamená to, že došlo k chemické reakci, pokud nejsou fixovány nebo asimilovány přímo ze vzduchu, hlavní zdroj plynů (povrchně) na planetě. Jak teploty stoupají, všechny látky (chemické prvky) se transformují na plyny, včetně kovů, jako je železo, zlato a stříbro..
Bez ohledu na chemickou povahu plynů mají všichni společnou velkou vzdálenost, která odděluje jejich částice (atomy, molekuly, ionty atd.), Které se chaoticky a libovolně pohybují daným objemem nebo prostorem..
Rejstřík článků
- 1 Vlastnosti plynů
- 1.1 Fyzické
- 1.2 Elektrická a tepelná vodivost
- 1.3 Reaktivita
- 2 Chování plynů
- 3 Forma plynů
- 4 Tlak plynu
- 4.1 Jednotky
- 5 Objem plynu
- 6 Hlavní zákony o plynu
- 6.1 Boyleův zákon
- 6.2 Charlesův zákon
- 6.3 Zákon Gay-Lussac
- 6.4 Avogadrův zákon
- 7 Druhy plynů
- 7.1 Hořlavé plyny
- 7.2 Průmyslové plyny
- 7.3 Inertní plyny
- 8 Příklady plynných prvků a sloučenin
- 8.1 Plynné sloučeniny
- 9 Odkazy
Vlastnosti plynů
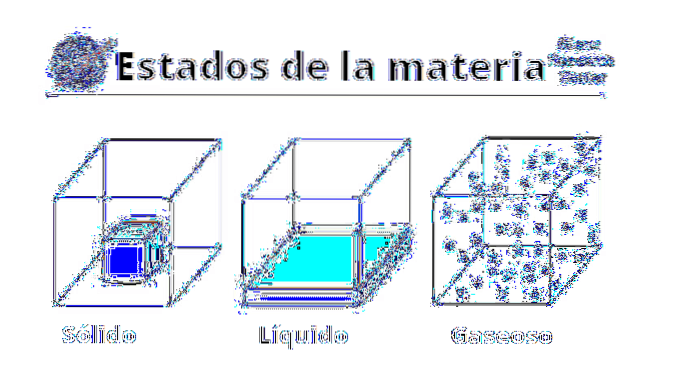
Fyzický
Fyzikální vlastnosti plynů se liší v závislosti na tom, o jakou látku nebo sloučeninu jde. Plyny jsou populárně spojovány se špatným zápachem nebo hnilobou, buď kvůli jejich obsahu síry, nebo kvůli přítomnosti těkavých aminů. Podobně jsou vizualizovány nazelenalými, hnědými nebo nažloutlými barvami, které zastrašují a dávají špatné znamení.
Většina plynů, nebo alespoň ty nejhojnější, je však ve skutečnosti bezbarvá a bez zápachu. I když jsou nepolapitelné, lze je na pokožce cítit a odolávají pohybu, dokonce vytvářejí viskózní vrstvy na tělech, které jimi procházejí (jako je tomu u letadel)..
Všechny plyny mohou podléhat změnám tlaku nebo teploty, které je nakonec promění v jejich příslušné kapaliny; to znamená, že trpí kondenzací (pokud jsou ochlazeny) nebo zkapalněním (pokud jsou „stlačeny“).

Na druhé straně jsou plyny schopné rozpouštět se v kapalinách a některých porézních pevných látkách (jako je aktivní uhlí). Bubliny jsou výsledkem akumulace plynů, které se v médiu ještě nerozpustily a unikají směrem k povrchu kapaliny..
Elektrická a tepelná vodivost
Za normálních podmínek (bez ionizace jejich částic) jsou plyny špatnými vodiči tepla a elektřiny. Když jsou však stresováni mnoha elektrony, umožňují jim proud projít, jak je vidět na blesku během bouří..
Na druhé straně se při nízkých tlacích a vystavení elektrickému poli rozsvítí některé plyny, zejména ty ušlechtilé nebo dokonalé, a jejich světla se používají pro design reklam a nočních plakátů (neonové světlo), stejně jako v slavné elektrické výbojky v pouličních lucernách.
Pokud jde o tepelnou vodivost, mnoho plynů se chová jako tepelné izolátory, takže jejich zabudování do výplně vláken, tkanin nebo skleněných desek pomáhá zabránit průchodu tepla a udržuje konstantní teplotu..
Existují však plyny, které jsou dobrými vodiči tepla a mohou způsobit horší popáleniny než ty, které způsobují kapaliny nebo pevné látky; například jako horká pára z upečených košíčků (nebo empanadas) nebo z parních trysek unikajících z kotlů.
Reaktivita
Obecně jsou reakce zahrnující plyny nebo tam, kde k nim dochází, klasifikovány jako nebezpečné a těžkopádné.
Jejich reaktivita opět závisí na jejich chemické povaze; Při velmi snadném rozšiřování a mobilizaci je však třeba věnovat větší pozornost a kontrolu, protože mohou vyvolat drastické zvýšení tlaku, které ohrožuje strukturu reaktoru; nemluvě o tom, jak hořlavé jsou plyny.
Chování plynů
Makroskopicky lze získat představu o chování plynů sledováním toho, jak se ve vzduchu vyvíjí kouř, prsteny nebo literární „jazyky“ cigaret. Podobně, když exploduje kouřový granát, je zajímavé podrobně popsat pohyb těchto různobarevných mraků.
Taková pozorování však podléhají působení vzduchu a také skutečnosti, že v kouři jsou suspendovány velmi jemné pevné částice. Tyto příklady proto nestačí k dosažení závěru o skutečném chování plynu. Místo toho byly provedeny experimenty a byla vyvinuta kinetická teorie plynů..
Molekulárně a v ideálním případě se plynné částice navzájem elasticky sráží a mají lineární, rotační a vibrační posuny. Mají přidruženou průměrnou energii, která jim umožňuje volně cestovat jakýmkoli prostorem, aniž by téměř naráželi nebo kolidovali s jinou částicí, jak se objem kolem nich zvětšuje..
Jeho chování by se stalo směsicí nevyzpytatelného Brownova pohybu a srážek některých kulečníkových koulí, které se neustále odrážejí mezi sebou a stěnami stolu; pokud zde nejsou žádné zdi, budou se rozptylovat směrem k nekonečnu, pokud nebudou zadrženy silou: gravitací.
Forma plynů
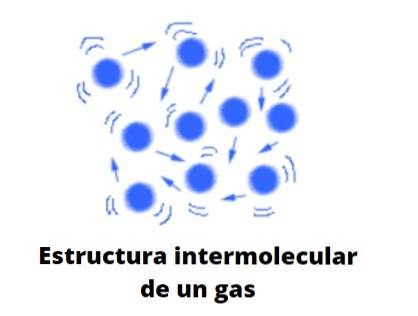
Plyny, na rozdíl od kapalin a pevných látek, nejsou hmotou kondenzovaného typu; tj. agregace nebo soudržnost jeho částic nikdy nedokáže definovat tvar. Sdílejí s tekutinami skutečnost, že zcela zabírají objem nádoby, která je obsahuje; chybí jim však povrchové a povrchové napětí.
Pokud je koncentrace plynu vysoká, lze jeho „jazyky“ nebo již popsané makroskopické formy vidět pouhým okem. Ty dříve či později skončí mizením působením větru nebo pouhou expanzí plynu. Plyny proto pokrývají všechny rohy omezeného prostoru a vytvářejí vysoce homogenní systémy.
Teorie nyní pohodlně považuje plyny za koule, které se sotva srazí; ale když to udělají, pružně odskočí.
Tyto koule jsou od sebe široce odděleny, takže plyny jsou prakticky „plné“ vakua; proto jeho univerzálnost procházet i nejmenší štěrbinou nebo prasklinou a snadnost, že je lze výrazně stlačit.
Proto, bez ohledu na to, jak je pekárna zavřená, pokud jdete vedle ní, určitě si užijete aroma čerstvě upečeného chleba..
Tlak plynu
Dalo by se věřit, že protože koule nebo částice plynu jsou tak rozptýleny a odděleny, nejsou schopné vytvářet jakýkoli tlak na těla nebo předměty. Atmosféra však dokazuje, že taková víra je falešná: má hmotnost, hmotnost a zabraňuje odpařování nebo varu kapalin z ničeho. Body varu se měří při atmosférickém tlaku.
Tlak plynu se stane měřitelnějším, pokud jsou k dispozici manometry nebo jsou-li uzavřeny v nádobách s nedeformovatelnými stěnami. Čím více plynových částic je uvnitř nádoby, tím větší je počet srážek mezi nimi a stěnami nádoby..
Když se tyto částice srazí se stěnami, stlačí je, protože na svůj povrch působí silou úměrnou jejich kinetické energii. Je to, jako by byly ideální kulečníkové koule házeny na zeď; pokud je jich mnoho, které na ně naráží vysokou rychlostí, mohlo by se to dokonce zlomit.
Jednotky
Existuje mnoho jednotek, které doprovázejí měření tlaku plynu. Mezi nejznámější patří milimetry rtuti (mmHg), například torr. Existují systémy mezinárodního systému jednotek (SI), které definují pascal (Pa) ve smyslu N / mdva; a z něj pascal kilo (kPa), mega (MPa) a giga (GPa).
Objem plynu
Plyn zabírá a expanduje po celém objemu nádoby. Čím větší je nádoba, tím bude také objem plynu; ale jeho tlak i hustota se sníží pro stejné množství částic.
Samotný plyn má na druhé straně přidružený objem, který nezávisí natolik na jeho povaze nebo molekulární struktuře (v ideálním případě), ale na tlakových a teplotních podmínkách, které jej řídí; to je jeho molární objem.
Ve skutečnosti se molární objem liší od jednoho plynu k druhému, i když variace jsou malé, pokud nejde o velké a heterogenní molekuly. Například molární objem amoniaku (NH3, 22 079 l / mol) při 0 ° C a 1 atm se liší od helia (He, 22 435 l / mol).
Všechny plyny mají molární objem, který se mění v závislosti na P a T, a bez ohledu na to, jak velké jsou jejich částice, je jejich počet vždy stejný. Odtud ve skutečnosti odvodil to, co je známé podle Avogadrova čísla (NNA).
Hlavní zákony o plynu
Chování plynů bylo po staletí studováno pomocí experimentů, hloubkových pozorování a interpretace výsledků..
Takové experimenty umožnily stanovit řadu zákonů, které dohromady ve stejné rovnici (rovnici ideálních plynů) pomáhají předpovídat reakce plynu na různé podmínky tlaku a teploty. Tímto způsobem existuje vztah mezi jeho objemem, teplotou a tlakem, jakož i počtem jeho molů v daném systému..
Mezi tyto zákony patří následující čtyři: Boyle, Charles, Gay-Lussac a Avogadro's.
Boyleův zákon
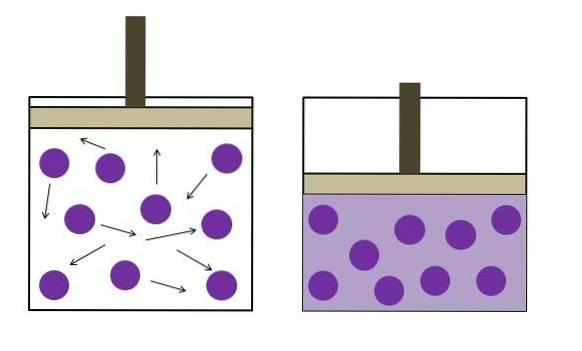
Boyleův zákon říká, že při konstantní teplotě je objem ideálního plynu nepřímo úměrný jeho tlaku; tj. čím větší je nádoba, tím nižší je tlak, který její stěny pocítí kvůli stejnému množství plynu..
Charles Law

Charlesův zákon stanoví, že při konstantním tlaku je objem ideálního plynu přímo úměrný jeho teplotě. Balónky ukazují Charlesův zákon, protože pokud jsou zahřáté, nafouknou se o něco více, zatímco pokud jsou ponořeny do kapalného dusíku, vyfouknou se, protože objem plynu v nich se zmenšuje..
Zákon Gay-Lussac
Gay-Lussacův zákon stanoví, že při konstantním objemu je tlak ideálního plynu přímo úměrný jeho teplotě. V dobře uzavřeném kotli, pokud se plyn zahřívá postupně, bude pokaždé tlak uvnitř větší, protože stěny kotle se nedeformují ani neroztahují; to znamená, že jeho objem se nemění, je konstantní.
Avogadrov zákon
A konečně Avogadrův zákon stanoví, že objem obsazený ideálním plynem je přímo úměrný počtu jeho částic. Pokud tedy máme jeden mol částic (6,02 · 102. 3), pak budeme mít molární objem plynu.
Druhy plynů
Hořlavé plyny
Jsou to ty plyny, jejichž složky fungují jako paliva, protože se používají k výrobě tepelné energie. Některé z nich jsou zemní plyn, zkapalněný ropný plyn a vodík.
Průmyslové plyny
Jsou to vyráběné plyny, které jsou prodávány veřejnosti pro různá použití a aplikace, například pro zdraví, potraviny, ochranu životního prostředí, metalurgii, chemický průmysl, bezpečnostní sektory atd. Některé z těchto plynů jsou mimo jiné kyslík, dusík, helium, chlor, vodík, oxid uhelnatý, propan, methan, oxid dusný..
Inertní plyny
Jsou to plyny, které za určitých teplotních a tlakových podmínek nevytvářejí žádnou chemickou reakci nebo jsou velmi nízké. Jsou to neon, argon, helium, krypton a xenon. Používají se v chemických procesech, ve kterých jsou nutné nereaktivní prvky.
Příklady plynných prvků a sloučenin
Jaké jsou plynné prvky periodické tabulky v zemských podmínkách?
Nejprve máme vodík (H), který tvoří molekuly H.dva. Následuje hélium (He), nejlehčí vzácný plyn; a poté dusík (N), kyslík (O) a fluor (F). Tyto poslední tři také tvoří diatomické molekuly: Ndva, NEBOdva a Fdva.
Po fluoru přichází neon (Ne), vzácný plyn, který následuje po heliu. Pod fluorem máme chlor (Cl) ve formě molekul Cldva.
Dále máme zbytek vzácných plynů: argon (Ar), krypton (Kr), xenon (Xe), radon (Rn) a oganeson (Og).
Jedná se tedy o celkem dvanáct plynných prvků; jedenáct, pokud vyloučíme vysoce radioaktivní a nestabilní oganeson.
Plynné sloučeniny
Kromě plynných prvků budou uvedeny některé běžné plynné sloučeniny:
-HdvaAno, sirovodík, zodpovědný za vůni shnilých vajec
-NH3, amoniak, štiplavá vůně nalezená v použitých mýdlech
-COdva, oxid uhličitý, skleníkový plyn
-NEdva, oxid dusičitý
-NO, oxid dusnatý, plyn, o kterém se věřilo, že je vysoce toxický, ale hraje důležitou roli v oběhovém systému
-SW3, oxid sírový
-C4H10, butan
-HC1, chlorovodík
-NEBO3, ozón
-SF6, fluorid sírový
Reference
- Whitten, Davis, Peck a Stanley. (2008). Chemie. (8. vydání). Učení CENGAGE.
- Vlastnosti plynů. Obnoveno z: chemed.chem.purdue.edu
- Wikipedia. (2019). Plyn. Obnoveno z: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (5. prosince 2018). Plyny - Obecné vlastnosti plynů. Obnoveno z: thoughtco.com
- Harvardské pánské hodinky pro zdraví. (2019). Stav plynu. Obnoveno z: health.harvard.edu
- Redaktoři chlazení elektroniky. (1. září 1998). Tepelná vodivost plynů. Obnoveno z: electronics-cooling.com



Zatím žádné komentáře