
Vlastnosti karbonylové skupiny, vlastnosti, názvosloví, reaktivita
The karbonylová skupina Jedná se o organickou a okysličenou funkční skupinu, která se podobá plynné molekule oxidu uhelnatého. Je reprezentován jako C = O, a přestože je považován za organický, lze jej nalézt také v anorganických sloučeninách; jako kyselina uhličitá, HdvaCO3, nebo v organokovových sloučeninách s CO jako pojivem.
Je to však chemie uhlíku, život, biochemie a další podobné vědecké obory, kde tato skupina vyniká svým nesmírným významem. Kdyby nebylo jeho, mnoho molekul by nebylo schopno interagovat s vodou; bílkoviny, cukry, aminokyseliny, tuky, nukleové kyseliny a další biomolekuly by neexistovaly, nebýt jeho.
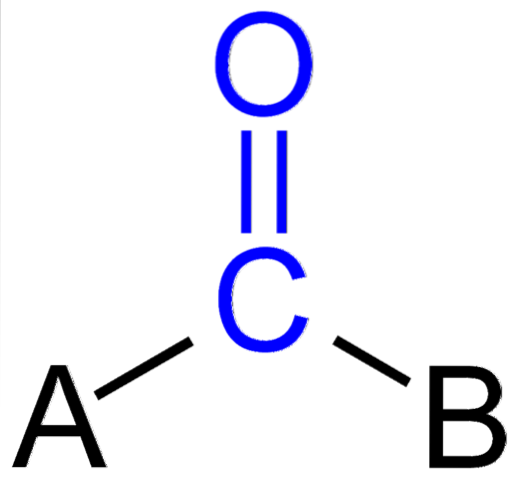
Obrázek výše ukazuje, jak tato skupina vypadá v obecné kostře sloučeniny. Všimněte si, že je zvýrazněno modrou barvou, a pokud bychom odstranili substituenty A a B (R nebo R ', stejně platné), molekula oxidu uhelnatého by zůstala. Přítomnost těchto substituentů definuje velké množství organických molekul.
Pokud A a B jsou atomy jiné než uhlík, jako jsou kovy nebo nekovové prvky, pak mohou obsahovat organokovové nebo anorganické sloučeniny. V případě organické chemie budou substituenty A a B vždy atomy vodíku, uhlíkové řetězce, linie, s větvemi nebo bez nich, cyklické nebo aromatické kruhy..
Takto začíná chápat, proč je karbonylová skupina zcela běžná pro ty, kteří studují přírodní nebo zdravotní vědy; je všude a bez ní by nenastaly molekulární mechanismy, které se dějí v našich buňkách.
Pokud by bylo možné shrnout jeho význam, dalo by se říci, že přispívá k polaritě, kyselosti a reaktivitě molekuly. Pokud existuje karbonylová skupina, je více než pravděpodobné, že právě v tomto bodě může molekula podstoupit transformaci. Proto je strategickým místem pro rozvoj organické syntézy oxidací nebo nukleofilními útoky..
Rejstřík článků
- 1 Vlastnosti a vlastnosti karbonylové skupiny
- 1.1 Rezonanční struktury
- 2 Názvosloví
- 3 Reaktivita
- 3.1 Nukleofilní útok
- 3.2 Redukce
- 3.3 Tvorba acetálů a ketálů
- 4 typy
- 5 Jak jej identifikovat v aldehydech a ketonech
- 5.1 Identifikace
- 6 Hlavní příklady
- 7 Reference
Vlastnosti a vlastnosti karbonylové skupiny
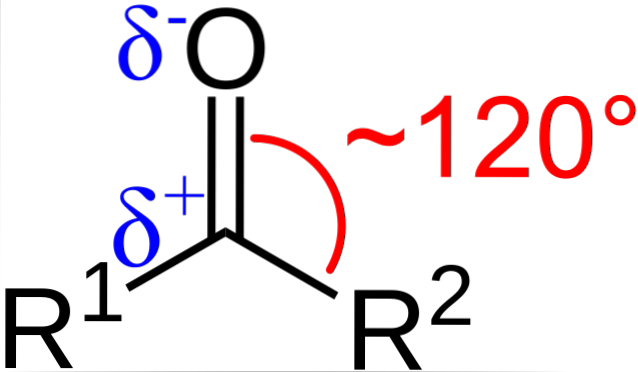
Jaké jsou strukturní a elektronické vlastnosti karbonylové skupiny? Nahoře je vidět, nyní s použitím písmen R1 a R.dva místo A a B existuje úhel 120 ° C mezi substituenty a atomem kyslíku; to znamená, že geometrie kolem této skupiny je trigonální rovina.
Aby taková geometrie byla, atomy uhlíku a kyslíku musí nutně mít sp chemickou hybridizacidva; uhlík tedy bude mít tři sp orbitalydva za vzniku jednoduchých kovalentních vazeb s R.1 a R.dva, a oběžnou dráhu p čisté k vytvoření dvojné vazby s kyslíkem.
To vysvětluje, jak může existovat dvojná vazba C = O.
Pokud je obraz pozorován, bude také vidět, že kyslík má vyšší elektronovou hustotu, δ-, než uhlík, δ +. To je způsobeno skutečností, že kyslík je více elektronegativní než uhlík, a proto jej „okrádá“ o elektronovou hustotu; a nejen on, ale také substituenty R.1 a R.dva.
V důsledku toho je generován permanentní dipólový moment, který může být větší nebo menší velikosti v závislosti na molekulární struktuře. Kdekoli je karbonylová skupina, budou dipólové momenty.
Rezonanční struktury
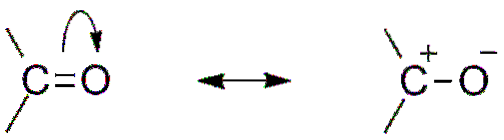
Dalším důsledkem elektronegativity kyslíku je to, že v karbonylové skupině existují rezonanční struktury, které definují hybrid (kombinace dvou struktur v horním obrázku). Všimněte si, že dvojice elektronů může migrovat směrem k orbitálu p kyslík, který opouští atom uhlíku s kladným částečným nábojem; karbokation.
Obě struktury se neustále navzájem nahrazují, takže uhlík udržuje stálý nedostatek elektronů; to znamená, že u kationtů, které jsou mu velmi blízké, dojde k elektrostatickému odpuzování. Pokud je to ale anion nebo druh schopný darovat elektrony, pocítíte silnou přitažlivost pro tento uhlík..
Pak dojde k tomu, co je známé jako nukleofilní útok, který bude vysvětlen v další části.
Nomenklatura
Pokud má sloučenina skupinu C = O, říká se o ní karbonylová skupina. V závislosti na povaze karbonylové sloučeniny tedy má svá vlastní pravidla nomenklatury.
I když, bez ohledu na to, co to je, všichni sdílejí společné pravidlo: C = O má v seznamu uhlíkových řetězců prioritu, když uvádí atomy uhlíku.
To znamená, že pokud existují větve, atomy halogenu, dusíkaté funkční skupiny, dvojné nebo trojné vazby, žádná z nich nemůže nést číslo lokátoru menší než C = O; nejdelší řetězec se proto začíná vyjmenovávat co nejblíže karbonylové skupině.
Pokud je naopak v řetězci několik C = O a jeden z nich je součástí vyšší funkční skupiny, pak karbonylová skupina bude nést větší lokátor a bude uvedena jako oxosubstituent..
A co je to za hierarchii? Následující, od nejvyšší po nejnižší:
-Karboxylové kyseliny, RCOOH
-Ester, RCOOR '
-Amida, RCONHdva
-Aldehyd, RCOH (nebo RCHO)
-Keton, RCOR
Substitucí R a R 'pro molekulární segmenty vzniká nespočet karbonylových sloučenin představovaných rodinami výše: karboxylové kyseliny, estery, amidy atd. S každým je spojena jeho tradiční nomenklatura nebo IUPAC nomenklatura..
Reaktivita
Nukleofilní útok
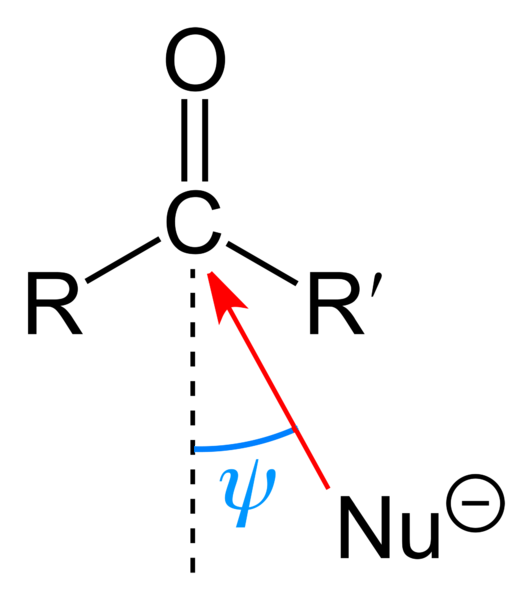
Horní obrázek ukazuje nukleofilní útok karbonylové skupiny. Nukleofil, Nu-, může to být anion nebo neutrální druh s dostupnými elektronovými páry; jako amoniak, NH3, například. Hledá výhradně uhlík, protože podle rezonančních struktur má kladný částečný náboj.
Kladný náboj přitahuje Nu-, který se bude snažit aproximovat takovým „bokem“, aby existovala nejméně sterická zábrana ze substituentů R a R '. Podle toho, jak jsou objemné, nebo podle velikosti Nu-, k útoku dojde pod různými úhly ψ; mohou být velmi otevřené nebo uzavřené.
Jakmile k útoku dojde, vytvoří se meziproduktová sloučenina Nu-CRR'-O-; to znamená, že kyslík je ponechán s párem elektronů, aby bylo možné přidat Nu- karbonylová skupina.
Tento záporně nabitý kyslík může zasahovat do dalších kroků reakce; protonovaný jako hydroxylová skupina, OH, nebo uvolněný jako molekula vody.
Zapojené mechanismy i reakční produkty získané tímto útokem jsou velmi rozmanité..
Deriváty
Nukleofilní látka Nu- může to být mnoho druhů. U každého konkrétně vznikají při reakci s karbonylovou skupinou různé deriváty.
Například, když je uvedeným nukleofilním činidlem amin, NHdvaR, iminy pocházejí, RdvaC = NR; pokud je to hydroxylamin, NHdvaOH, dává vzniknout oximům, RR'C = NOH; pokud je to kyanidový anion, CN-, vyrábějí se kyanohydriny, RR'C (OH) CN atd. s jinými druhy.
Snížení
Nejprve bylo řečeno, že tato skupina je okysličována, a proto oxidována. To znamená, že za daných podmínek jej lze snížit nebo ztratit vazby s atomem kyslíku jeho nahrazením vodíky. Například:
C = O => CHdva
Tato transformace naznačuje, že karbonylová skupina byla redukována na methylenovou skupinu; došlo ke ztrátě vodíku v důsledku ztráty kyslíku. Vhodnější chemické pojmy: karbonylová sloučenina se redukuje na alkan.
Pokud se jedná o keton, RCOR ', v přítomnosti hydrazinu, HdvaN-NHdva, a silně bazické médium lze redukovat na příslušný alkan; Tato reakce je známá jako Wolff-Kishnerova redukce:
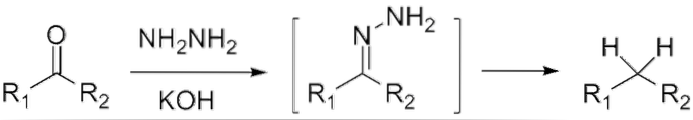
Pokud se naopak reakční směs skládá z amalgamovaného zinku a kyseliny chlorovodíkové, je reakce známá jako Clemmensenova redukce:
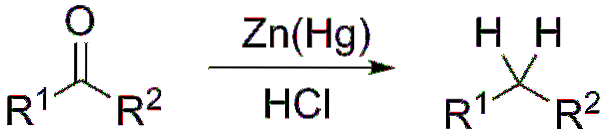
Tvorba acetaly a ketaly
Karbonylová skupina může nejen přidávat nukleofilní činidla Nu-, ale za kyselých podmínek může také reagovat s alkoholy podobnými mechanismy.
Když aldehyd nebo keton částečně reaguje s alkoholem, vznikají hemiacetaly nebo hemicetaly. Pokud je reakce úplná, jsou to produkty acetaly a ketaly. Následující chemické rovnice shrnují a objasňují, co bylo právě zmíněno:
RCHO + R3OH g RCHOH (OR3) (Hemiacetal) + R4OH g RCH (OR3) (NEBO4) (Acetal)
RCORdva + R3OH g RCORdva(OH) (OR3) (Hemiketal) + R4OH g RCORdva(NEBO3) (NEBO4) (ketal)
První reakce odpovídá tvorbě hemiacetalů a acetalů z aldehydu a druhá hemicetalů a ketalů z ketonu.
Tyto rovnice nemusí být dostatečně jednoduché, aby vysvětlily vznik těchto sloučenin; Pro první přístup k předmětu však stačí pochopit, že se přidávají alkoholy a že jejich postranní řetězce R (R3 a R.4) se naváže na karbonylový uhlík. Proto se přidávají NEBO3 a NEBO4 k původní molekule.
Hlavním rozdílem mezi acetalem a ketálem je přítomnost atomu vodíku vázaného na uhlík. Pamatujte, že v ketonu chybí tento vodík.
Typy
Velmi podobné, jak je vysvětleno v části nomenklatury pro karbonylovou skupinu, její typy jsou funkcí, kterou jsou substituenty A a B nebo R a R '. Proto existují strukturní charakteristiky, které sdílejí řadu karbonylových sloučenin nad rámec řádu nebo typu vazeb..
Například byla zmíněna na začátku analogie mezi touto skupinou a oxidem uhelnatým, C20. Pokud molekula postrádá atomy vodíku a pokud existují také dva koncové C = O, pak to bude oxid uhličitý, CnNEBOdva. Pro n rovné 3 budeme mít:
O = C = C = C = O
Což je, jako by tam byly dvě molekuly C≡O spojené a oddělené uhlíkem.
Karbonylové sloučeniny lze odvodit nejen z plynu CO, ale také z kyseliny uhličité HdvaCO3 nebo OH- (C = O) -OH. Zde dva OH představují R a R 'a nahrazením jednoho z nich nebo jejich vodíků se získají deriváty kyseliny uhličité.
A pak existují deriváty karboxylových kyselin, RCOOH, získané změnou identity R nebo nahrazením H za jiný atom nebo řetězec R '(což by vedlo k vzniku esteru, RCOOR')..
Jak jej identifikovat v aldehydech a ketonech
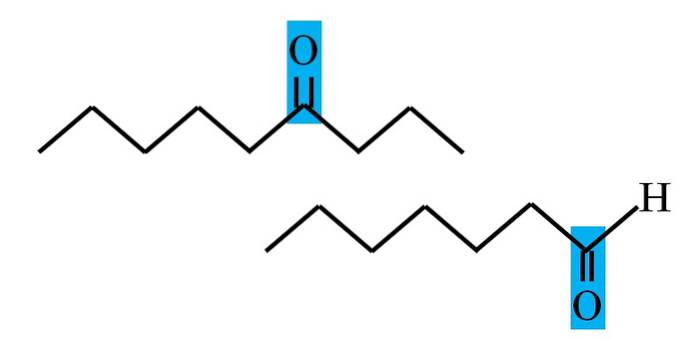
Jak aldehydy, tak ketony mají společnou přítomnost karbonylové skupiny. Jsou to jeho chemické a fyzikální vlastnosti. Jejich molekulární prostředí však není v obou sloučeninách stejné; v první je v koncové poloze a v druhé kdekoli v řetězci.
Například na obrázku nad je karbonylová skupina uvnitř modrého rámečku. V ketonech musí být vedle tohoto boxu další uhlíkový nebo řetězový segment (nahoře); zatímco v aldehydech může být pouze jeden atom vodíku (dole).
Pokud je C = O na jednom konci řetězce, bude to aldehyd; to je nejpřímější způsob, jak jej odlišit od ketonu.
ID
Jak ale experimentálně víte, zda neznámá sloučenina je aldehyd nebo keton? Existuje řada metod, od spektroskopických (absorpce infračerveného záření, IR) nebo kvalitativních organických testů.
Pokud jde o kvalitativní testy, ty jsou založeny na reakcích, které, pokud jsou pozitivní, analytik pozoruje fyzickou reakci; změna barvy, uvolnění tepla, tvorba bublin atd..
Například při přidání kyselého roztoku K.dvaCrdvaNEBO7 aldehyd se změní na karboxylovou kyselinu, což způsobí, že se barva roztoku změní z oranžové na zelenou (pozitivní test). Ketony zatím nereagují, a proto analytik nepozoruje žádnou změnu barvy (negativní test).
Další test spočívá v použití Tollensova činidla [Ag (NH3)dva]+, pro aldehyd ke snížení Ag kationtů+ na kovové stříbro. A výsledek: tvorba stříbrného zrcadla ve spodní části zkumavky, kde byl umístěn vzorek..
Hlavní příklady
Na závěr bude uvedena řada příkladů karbonylových sloučenin:
-CH3COOH, kyselina octová
-HCOOH, kyselina mravenčí
-CH3Auto3, propanon
-CH3AutodvaCH3, 2-butanon
-C6H5Auto3, acetofenon
-CH3CHO, ethanal
-CH3CHdvaCHdvaCHdvaCHO, pentanal
-C6H5CHO, benzaldehyd
-CH3CONHdva, acetamid
-CH3CHdvaCHdvaCOOCH3, propyl-acetát
Pokud jsou nyní citovány příklady sloučenin, které tuto skupinu jednoduše vlastní, seznam by se stal téměř nekonečným.
Reference
- Morrison, R. T. a Boyd, R, N. (1987). Organická chemie. 5. vydání. Redakční Addison-Wesley Interamericana.
- Carey F. (2008). Organická chemie. (Šesté vydání). Mc Graw Hill.
- Graham Solomons T.W., Craig B.Fryhle. (2011). Organická chemie. Miny. (10. vydání.). Wiley plus.
- Reid Danielle. (2019). Karbonylová skupina: Vlastnosti a přehled. Studie. Obnoveno z: study.com
- Sharleen Agvateesiri. (5. června 2019). Karbonylová skupina. Chemistry LibreTexts. Obnoveno z: chem.libretexts.org
- Wiki Kids Ltd. (2018). Karbonylové sloučeniny. Obnoveno z: simply.science
- Toppr. (s.f.). Nomenklatura a struktura karbonylové skupiny. Obnoveno z: toppr.com
- Clark J. (2015). Oxidace aldehydů a ketonů. Obnoveno z: chemguide.co.uk


Zatím žádné komentáře