
Vlastnosti hemolysinu, typy, mechanismy působení

The hemolyzin Jedná se o malý protein, který způsobuje póry v buněčné membráně erytrocytů a některých dalších buňkách krve savců. Obvykle je syntetizován a vylučován patogenními bakteriemi.
Tento protein je jedním z nejběžnějších mikrobiálních toxinů a ten, který byl nejlépe studován. Někdy to může způsobit hemolytickou anémii, protože počet kanálů, kterými prochází buněčné vnitřek, může dokonce způsobit lýzu buněk.
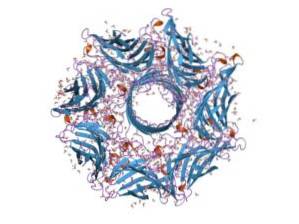
Obecně je hemolyzin typickým toxinem druhu Streptococcus střevního traktu. Jeho funkce umožňuje bakteriím prolomit epiteliální bariéru střevního traktu a tak se pohybovat krevním řečištěm a kolonizovat další tkáně..
Nejběžnější formou, kterou se hemolyzin v přírodě vyskytuje, je jeho forma α-hemolysinu. Tento protein je jedním z nejdůležitějších faktorů virulence většiny kmenů Escherichia coli a některé klostridie.
Většina infekcí močových cest je způsobena kmeny Escherichia coli produkující α-hemolyzin s hemolytickými vlastnostmi.
Produkce hemolysinu a bakteriocinu v bakteriálních kmenech souvisela s mechanismem konkurence proti ostatním druhům a zdá se, že produkce obou toxinů závisí na stejných genetických faktorech v genomu bakterií..
Rejstřík článků
- 1 Funkce
- 2 druhy
- 2,1 α-hemolyzin
- 2,2 β-hemolyzin
- 2,3 γ-hemolyzin
- 3 Mechanismy působení
- 3.1 Membránová vazba
- 3.2 Zavádění toxinu do membrány
- 3.3 oligomerizace
- 4 Odkazy
Vlastnosti
Hemolysin se skládá ze sedmi podjednotek a gen, který jej kóduje, má sedm promotorů. Těchto sedm podjednotek se vloží do plazmatické membrány cílových buněk a když se spojí, vytvoří iontový kanál, kterým unikají metabolity z vnitřku buňky..
Hemolysin je extracelulární vápník (Ca + 2) závislý cytotoxin, který působí na plazmatickou membránu buněk krevního řečiště. Póry, které vytváří v membráně, jsou také hydrofilní a způsobují vstup vody do vnitřku buňky, což může vést k lýze..
Hemolysiny jsou typické proteinové produkty gramnegativních bakterií a všechny mají dvě vlastnosti:
1- Přítomnost velmi malého peptidu (nonapeptidu) tvořeného opakováním aminokyselin glycinu a kyseliny asparagové. Nonapeptidy hemolysinu jsou umístěny blízko C-terminální části primární struktury proteinu.
2 - Všechny hemolysiny jsou bakteriemi vylučovány do extracelulárního prostředí prostřednictvím transportéru typu ABC (ATP-Binding Cassette).
Produkce hemolysinu je obvykle detekována v bakteriálních kmenech prostřednictvím růstu na médiu na krevním agaru. Při testu byl pozorován hemolytický halo, produkt rozkladu červených krvinek v blízkosti bakteriálních kolonií.
Typy
Existuje několik různých typů hemolysinů, které jsou klasifikovány řeckým písmenem na začátku jejich názvu. Nejvíce studované a běžné jsou α, β a γ hemolysiny, všechny produkované kmenem Zlatý stafylokok.
Typy hemolysinu jsou klasifikovány podle rozsahu buněk, na které útočí, a podle jejich primární struktury proteinu..
α-hemolyzin
Tento protein je typický pro kmeny Zlatý stafylokok Y Escherichia coli; napadá neutrofily, červené krvinky, lymfocyty, makrofágy, dospělé a embryonální fibroblasty. Interakce s polárními hlavami lipidů plazmatické membrány těchto buněk za účelem internalizace hydrofobního ocasu asi 5 Ӑ uvnitř membrány.
β-hemolyzin
Produkovaný Zlatý stafylokok V menší míře než α-hemolyzin β-hemolyzin primárně napadá erytrocyty a vstupuje do membrány výhradně doménami buněčné membrány bohaté na sfingomyelin..
y-hemolyzin
Bylo také pozorováno v Zlatý stafylokok. Byl klasifikován jako hemolytický protein a leukotoxin současně, protože ovlivňuje polymorfonukleární buňky člověka, monocyty, makrofágy a zřídka i červené krvinky.
Tento typ γ-hemolysinu je jedním z nejméně charakterizovaných, proto je velká část jeho mechanismu účinku neznámá a nebyl zkoumán in vivo.
Akční mechanismy
Mechanismus účinku, který byl relativně jasně objasněn, je mechanismus a-hemolysinu. Jelikož se však jedná o hemolytické proteiny, předpokládá se, že většina procesů je společná pro všechny hemolysiny..
Vědci naznačují, že aby bakterie vylučovaly hemolysin do prostředí, musí se nacházet v mikroprostředí chudém na živiny, proto by to byl mechanismus, který spouští buňku, aby zničila cílové buňky a získala jejich živiny..
Mechanismus byl popsán ve třech krocích: vazba na buněčnou membránu, inzerce a oligomerizace..
Membránová vazba
Bylo zjištěno, že hemolysiny se mohou vázat na integriny neutrofilů a v erytrocytech se zjistilo, že se tyto proteiny vážou na glykosylované složky, jako jsou glykoproteiny, gangliosidy a glykoforiny buněčné membrány..
Někteří autoři naznačují, že přítomnost receptorů na membráně není nezbytná pro navázání hemolysinů. V každém případě není mechanismus buněčného opětovného stravování proteinu dosud přesně znám..
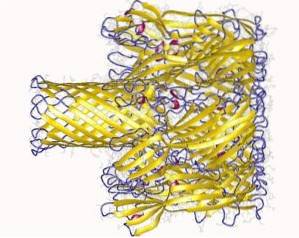
Interakce s membránou probíhá ve dvou krocích:
- Počáteční vazba (reverzibilní): když se hemolyzin váže na vápník vázající domény membrány. K tomuto kroku dochází na povrchu a je velmi citlivý na elektrostatický výboj..
- Ireverzibilní vazba: spojuje aminokyselinové domény s lipidovými složkami vnější vrstvy plazmatické membrány cílových buněk za účelem vytvoření fyzických vazeb mezi hydrofobními sloučeninami membrány.
Zavádění toxinu do membrány
Α-Hemolysin vloží zbytky 177 a 411 do první lipidové monovrstvy. V extracelulárním prostředí je hemolyzin spojen s ionty vápníku, které v něm indukují strukturní uspořádání a přispívají k jeho aktivaci..
Tato inzerce upevňuje nevratné připojení k buněčné membráně. Jakmile dojde k uspořádání, stává se hemolyzin integrálním proteinem, protože experimentálně se ukázalo, že jediným způsobem, jak jej extrahovat z membrány, je použití detergentů, jako je Triton X-100..
Oligomerizace
Když je veškerý hemolyzin vložen do plazmatické membrány cílových buněk, dochází k oligomerizaci 7 podjednotek, které ji tvoří, která končí tvorbou proteinového póru, velmi dynamického, ale závislého na lipidovém složení membrány ..
Bylo pozorováno, že proces oligomerace je upřednostňován mikrodoménami nebo lipidovými rafty buněčné membrány. Tyto oblasti nemusí upřednostňovat vazbu proteinu, ale po vložení upřednostňují jeho oligomerizaci..
Čím více hemolysinů se váže na membránu, tím více pórů se vytvoří. Kromě toho se hemolysiny mohou navzájem oligomerizovat (sousední) a vytvářet mnohem větší kanály..
Reference
- Bakás, L., Ostolaza, H., Vaz, W. L., & Goñi, F. M. (1996). Reverzibilní adsorpce a nevratná inzerce Escherichia coli alfa-hemolysinu do lipidových dvojvrstev. Biofyzikální časopis, 71 (4), 1869-1876.
- Dalla Serra, M., Coraiola, M., Viero, G., Comai, M., Potrich, C., Ferreras, M.,… & Prévost, G. (2005). Staphylococcus aureus, dvousložkové y-hemolysiny, HlgA, HlgB a HlgC, mohou tvořit smíšené póry obsahující všechny složky. Journal of Chemical Information and Modeling, 45 (6), 1539-1545.
- Gow, J. A., & Robinson, J. (1969). Vlastnosti purifikovaného stafylokokového β-hemolysinu. Journal ofacteriology, 97 (3), 1026-1032.
- Ike, Y., Hashimoto, H., & Clewell, D. B. (1984). Hemolyzin Streptococcus faecalis poddruh zymogenes přispívá k virulenci u myší. Infekce a imunita, 45 (2), 528-530.
- Remington, J. S., Klein, J. O., Wilson, C. B., Nizet, V., & Maldonado, Y. A. (Eds.). (1976). Infekční onemocnění plodu a novorozence (svazek 4). Philadelphia: Saunders.
- Todd, E. W. (1932). Antigenní streptokokový hemolyzin. Journal of experimentální medicíny, 55 (2), 267-280.


Zatím žádné komentáře