
Vlastnosti a příklady nenasycených uhlovodíků

The nenasycené uhlovodíky jsou ty, které obsahují ve své struktuře alespoň jednu dvojnou vazbu uhlíku a jsou schopny obsahovat trojnou vazbu, protože nasycení řetězce znamená, že přijal všechny možné atomy vodíku v každém uhlíku a neexistují páry volných elektronů, kde může vstoupit více vodíků.
Nenasycené uhlovodíky se dělí na dva typy: alkeny a alkyny. Alkeny jsou uhlovodíkové sloučeniny, které mají ve své molekule jednu nebo více dvojných vazeb. Alkyny jsou mezitím uhlovodíkové sloučeniny, které mají ve svém vzorci jednu nebo více trojných vazeb..
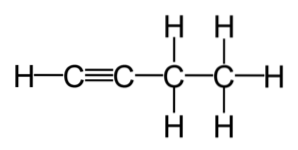
Alkeny a alkyny se často komerčně používají. Jedná se o sloučeniny s vyšší úrovní reaktivity než u nasycených uhlovodíků, což z nich dělá výchozí bod mnoha reakcí generovaných z nejběžnějších alkenů a alkynů..
Rejstřík článků
- 1 Názvosloví
- 1.1 Názvosloví alkenů
- 1.2 Názvosloví alkynů
- 2 Vlastnosti
- 2.1 Dvojité a trojné vazby
- 2.2 cis-trans izomerizace
- 2.3 Kyselost
- 2.4 Polarita
- 2.5 Teplota varu a tání
- 3 příklady
- 3.1 Ethylen (C2H4)
- 3.2 Ethine (C2H2)
- 3.3 Propylen (C3H6)
- 3.4 Cyklopenten (C5H8)
- 4 Články zájmu
- 5 Reference
Nomenklatura
Nenasycené uhlovodíky jsou pojmenovány odlišně podle toho, zda se jedná o alkeny nebo alkyny, pomocí přípon „-eno“ a „-ino“.
Alkeny mají ve své struktuře alespoň jednu dvojnou vazbu uhlík-uhlík a mají obecný vzorec CnH2n, zatímco alkyny obsahují alespoň jednu trojnou vazbu a jsou zpracovány vzorcem CnH2n-2.
Názvosloví alkenů
Pro pojmenování alkenů je třeba uvést polohy dvojných vazeb uhlík-uhlík. Názvy chemických sloučenin, které obsahují vazby C = C, končí příponou „-eno“.
Stejně jako u alkanů je název bazické sloučeniny určen počtem atomů uhlíku v nejdelším řetězci. Například molekula CHdva= CH-CHdva-CH3 se bude jmenovat „1-buten“, ale H3C-CH = CH-CH3 bude si říkat „2-buten“.
Čísla, která jsou pozorována v názvech těchto sloučenin, označují atom uhlíku s nejmenším počtem v řetězci, ve kterém se nachází vazba C = C alkenu..
Počet atomů uhlíku v tomto řetězci označuje předponu názvu, podobnou alkanům („met-“, „et-“, „pro-“, „but-“ atd.), Ale vždy s příponou „-eno ".
Musí být také specifikováno, zda je molekula cis nebo trans, což jsou typy geometrických izomerů. Toto se přidává do názvu, jako je 3-ethyl-cis-2-heptan nebo 3-ethyl-trans-2-heptan.
Názvosloví alkynů
Abychom uhodli názvy chemických sloučenin, které obsahují trojné vazby C≡C, je název sloučeniny určen počtem atomů C v nejdelším řetězci.
Podobně jako v případě alkenů, názvy alkynů označují pozici, ve které se nachází trojná vazba uhlík-uhlík; například v případě HC≡C-CHdva-CH3, nebo "1-butin" a H3C-C≡C-CH3, nebo „2-butyne“.
Vlastnosti
Nenasycené uhlovodíky obsahují obrovské množství různých molekul, a proto představují řadu charakteristik, které je definují a které jsou uvedeny níže:
Dvojité a trojné vazby
Dvojné a trojné vazby alkenů a alkynů mají speciální vlastnosti, které je odlišují od jednoduchých vazeb: jednoduchá vazba představuje nejslabší ze tří, která je tvořena vazbou sigma mezi dvěma molekulami.
Dvojná vazba je tvořena jednou sigma vazbou a jednou pi a trojná vazba jednou sigma vazbou a dvěma pi. Díky tomu jsou alkeny a alkyny silnější a vyžaduje více energie k rozpadu, když dojde k reakcím..
Dále jsou vazebné úhly, které jsou vytvořeny ve dvojné vazbě, 120 °, zatímco úhly trojné vazby jsou 180 °. To znamená, že molekuly s trojnými vazbami mají mezi těmito dvěma uhlíky lineární úhel..
Cis-trans izomerizace
U alkenů a jiných sloučenin s dvojnými vazbami dochází k geometrické izomerizaci, která se liší na straně vazeb, ve kterých se nacházejí funkční skupiny, které jsou připojeny k uhlíkům zapojeným do této dvojné vazby..
Když jsou funkční skupiny alkenu orientovány ve stejném směru vzhledem k dvojné vazbě, tato molekula se označuje jako cis, ale když jsou substituenty v různých směrech, nazývá se trans.
Tato izomerizace není jednoduchý rozdíl v umístění; sloučeniny se mohou značně lišit jen proto, že se jedná o cis geometrii nebo trans geometrii.
Cis sloučeniny obvykle zahrnují dipól-dipólové síly (které mají čistou hodnotu nula v trans); Kromě toho mají vyšší polaritu, teplotu varu a teploty tání a mají vyšší hustotu než jejich protějšky trans. Trans sloučeniny jsou navíc stabilnější a uvolňují méně spalovacího tepla..
Kyselost
Alkeny a alkyny mají vyšší kyselost ve srovnání s alkany kvůli polaritě jejich dvojných a trojných vazeb. Jsou méně kyselé než alkoholy a karboxylové kyseliny; a ze dvou jsou alkyny kyselější než alkeny.
Polarita
Polarita alkenů a alkynů je nízká, ještě více u transalkenových sloučenin, díky čemuž jsou tyto sloučeniny nerozpustné ve vodě..
Nenasycené uhlovodíky se přesto snadno rozpouštějí v běžných organických rozpouštědlech, jako jsou ethery, benzen, tetrachlormethan a další sloučeniny s nízkou nebo žádnou polaritou..
Teplota varu a tání
Vzhledem k jejich nízké polaritě jsou teploty varu a teploty tání nenasycených uhlovodíků nízké, téměř ekvivalentní těm u alkanů, které mají stejnou uhlíkovou strukturu..
Přesto mají alkeny nižší teploty varu a teploty tání než odpovídající alkany a jsou schopné snížit ještě více, pokud jsou cis izomerní, jak již bylo uvedeno..
Naproti tomu alkyny mají vyšší teploty varu a teploty tání než alkany a odpovídající alkeny, i když rozdíl je jen několik stupňů..
A konečně, cykloalkeny mají také nižší teploty tání než odpovídající cykloalkany, kvůli tuhosti dvojné vazby..
Příklady
Ethylen (C.dvaH4)
Silná chemická sloučenina díky své polymerační, oxidační a halogenační kapacitě.
Ethyne (C.dvaHdva)
Také se nazývá acetylen, jedná se o hořlavý plyn, který se používá jako užitečný zdroj osvětlení a tepla..
Propylen (C.3H6)
Druhá celosvětově nejpoužívanější sloučenina v chemickém průmyslu, je jedním z produktů termolýzy ropy.
Cyklopenten (C.5H8)
Sloučenina cykloalkenového typu. Tato látka se používá jako monomer pro syntézu plastů.
Články zájmu
Nasycené uhlovodíky nebo alkany.
Reference
- Chang, R. (2007). Chemistry, deváté vydání. Mexiko: McGraw-Hill.
- Wikipedia. (s.f.). Alkenes. Citováno z en.wikipedia.org
- Boudreaux, K. A. (s.f.). Nenasycené uhlovodíky. Citováno z angelo.edu
- Tuckerman, M. E. (s.f.). Alkeny a Alkyny. Citováno z nyu.edu
- University, L. T. (s.f.). Nenasycené uhlovodíky: Alkeny a Alkyny. Obnoveno z chem.latech.edu



Zatím žádné komentáře