
Charakteristiky, typy a mechanismus katalytické hydrogenace
The katalytická hydrogenace Jedná se o reakci, při které se molekulární vodík přidává ke sloučenině vyšší rychlostí. Molekula Hdva Nejen, že musí nejprve rozbít svou kovalentní vazbu, ale také být tak malý, efektivní srážky mezi ním a sloučeninou, ke které bude přidán, jsou méně pravděpodobné..
Sloučenina vodíkového receptoru může být buď organická nebo anorganická. V organických sloučeninách se nachází většina příkladů katalytické hydrogenace; zejména ty, které mají farmakologickou aktivitu nebo které mají ve svých strukturách zabudované kovy (organokovové sloučeniny).
Co se stane, když se přidá Hdva na strukturu plnou uhlíku? Jeho nenasycenost klesá, to znamená, že uhlík dosahuje maximálního stupně jednoduchých vazeb, které může vytvořit.
Proto je Hdva přidává se k dvojným (C = C) a trojným (C≡C) vazbám; ačkoli to může také být přidáno do karbonylových skupin (C = O).
Přidané alkeny a alkyny tedy reagují katalytickou hydrogenací. Povrchní analýzou jakékoli struktury lze předpovědět, zda přidá H či nikolidva pouhou detekcí dvojných a trojných vazeb.
Rejstřík článků
- 1 Charakteristika katalytické hydrogenace
- 1.1 Přerušení vodíkové vazby
- 1.2 Experimentální
- 2 druhy
- 2.1 Homogenní
- 2.2 Heterogenní
- 3 Mechanismus
- 4 Odkazy
Vlastnosti katalytické hydrogenace
Obrázek ukazuje mechanismus této reakce. Před jeho popisem je však nutné se věnovat některým teoretickým aspektům.
Povrchy šedých kuliček představují kovové atomy, které, jak bude vidět, jsou katalyzátory hydrogenace par excellence..
Vodíková vazba se rozpadá
Nejprve je hydrogenací exotermická reakce, tj. Uvolňuje teplo v důsledku tvorby sloučenin s nižší energií..
To je vysvětleno stabilitou vytvořených C-H vazeb, které vyžadují více energie pro jejich následné rozbití, než je požadováno H-H vazbou molekulárního vodíku..
Na druhou stranu hydrogenace vždy zahrnuje nejprve rozbití vazby H-H. Tato ruptura může být homolytická, jak se to stává v mnoha případech:
H-H => H ∙ + ∙ H
Nebo heterolytický, který může nastat, například když je oxid zinečnatý, ZnO, hydrogenován:
H-H => H+ + H-
Všimněte si, že rozdíl mezi těmito dvěma zlomy spočívá v tom, jak jsou distribuovány elektrony ve vazbě. Pokud jsou distribuovány rovnoměrně (kovalentně), každý H skončí s konzervací jednoho elektronu; zatímco je-li přepážka iontová, skončí bez elektronů, H+, a ten druhý je úplně vyhraje, H-.
Obě ruptury jsou možné při katalytické hydrogenaci, ačkoli homolytická umožňuje ustoupit vývoji logického mechanismu..
Experimentální
Vodík je plyn, a proto musí být probubláván a musí být zajištěno, že na povrchu kapaliny převažuje pouze on..
Na druhé straně musí být sloučenina, která má být hydrogenována, solubilizována v médiu, ať už je to voda, alkohol, ether, estery nebo kapalný amin; jinak by hydrogenace probíhala velmi pomalu.
Rozpuštěná sloučenina, která má být hydrogenována, musí být v reakčním prostředí také katalyzátor. To bude zodpovědné za zrychlení rychlosti reakce.
Při katalytické hydrogenaci se často používají jemně rozptýlené kovy niklu, palladia, platiny nebo rhodia, které jsou nerozpustné téměř ve všech organických rozpouštědlech. Budou tedy dvě fáze: kapalná s rozpuštěnou sloučeninou a vodíkem a pevná fáze s katalyzátorem..
Tyto kovy poskytují svůj povrch pro reakci vodíku a sloučeniny takovým způsobem, že se urychlí rozbíjení vazeb..
Podobně snižují difúzní prostor druhu a zvyšují počet účinných molekulárních kolizí. Nejen to, ale i reakce probíhá uvnitř pórů kovu..
Typy
Homogenní
Mluvíme o homogenní katalytické hydrogenaci, když reakční prostředí sestává z jedné fáze. Zde není místo pro použití kovů v jejich čistých stavech, protože jsou nerozpustné.
Místo toho se používají organokovové sloučeniny těchto kovů, které jsou rozpustné a bylo prokázáno, že mají vysoké výtěžky..
Jednou z těchto organokovových sloučenin je Wilkinsonův katalyzátor: tris (trifenylfosfin) rhodiumchlorid, [(C6H5)3P]3RhCl. Tyto sloučeniny tvoří komplex s Hdva, jeho aktivaci pro jeho následnou adiční reakci na alken nebo alkyn.
Homogenní hydrogenace má mnohem více alternativ než heterogenní. Proč? Protože chemie je organokovových sloučenin je hojná: stačí vyměnit kov (Pt, Pd, Rh, Ni) a ligandy (organické nebo anorganické molekuly spojené s kovovým středem), aby se získal nový katalyzátor.
Heterogenní
Heterogenní katalytická hydrogenace, jak již bylo zmíněno, má dvě fáze: jednu kapalnou a druhou pevnou..
Kromě kovových katalyzátorů existují ještě další, které sestávají z pevné směsi; například Lindlarův katalyzátor, který je vyroben z platiny, uhličitanu vápenatého, octanu olovnatého a chinolinu.
Lindlarův katalyzátor má tu zvláštnost, že je nedostatečný pro hydrogenaci alkenů; Je to však velmi užitečné pro částečnou hydrogenaci, to znamená, že funguje výborně na alkyny:
RC≡CR + Hdva => RHC = CHR
Mechanismus
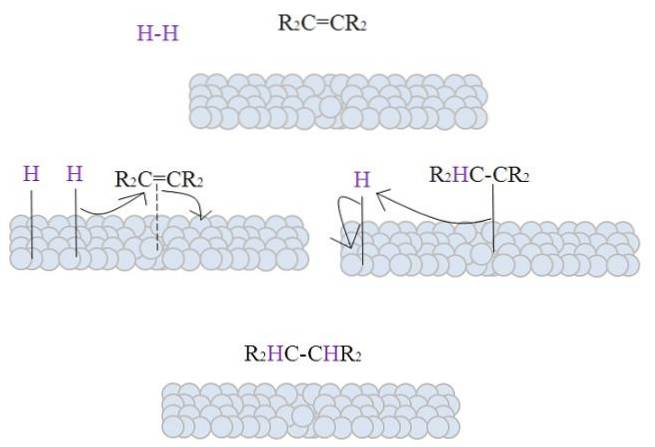
Obrázek ukazuje mechanismus katalytické hydrogenace s použitím práškového kovu jako katalyzátoru.
Šedavé koule odpovídají kovovému povrchu, řekněme, platiny. Molekula Hdva (fialová barva) se blíží povrchu kovu stejně jako tetra substituovaný alken, RdvaC = CRdva.
Hdva interaguje s elektrony, které procházejí atomy kovu, a dochází k prasknutí a tvorbě dočasné vazby H-M, kde M je kov. Tento proces je znám jako chemisorpce; tj. adsorpce chemickými silami.
Alken interaguje podobným způsobem, ale vazba je tvořena jeho dvojnou vazbou (tečkovaná čára). Vazba H-H již disociovala a každý atom vodíku zůstává navázán na kov; stejným způsobem to dělá s kovovými centry v organokovových katalyzátorech a tvoří tak přechodný komplex H-M-H.
Pak dojde k migraci H směrem k dvojné vazbě a ta se otevře a vytvoří vazbu s kovem. Zbývající H se poté váže na druhý uhlík původní dvojné vazby a produkovaný alkan, R, se nakonec uvolní.dvaHC-CHRdva.
Tento mechanismus se bude opakovat tolikrát, kolikrát bude nutné, dokud nebude vše Hdva plně reagovali.
Reference
- Graham Solomons T.W., Craig B.Fryhle. (2011). Organická chemie. Miny. (10th edice.). Wiley plus.
- Carey F. (2008). Organická chemie. (Šesté vydání). Mc Graw Hill.
- Shiver & Atkins. (2008). Anorganická chemie. (Čtvrté vydání). Mc Graw Hill.
- Lew J. (s.f.). Katalytická hydrogenace alkenů. Chemistry LibreTexts. Obnoveno z: chem.libretexts.org
- Jones D. (2018). Co je to katalytická hydrogenace? - Mechanismus a reakce. Studie. Obnoveno z: study.com



Zatím žádné komentáře