
Struktura hydridu lithného, vlastnosti, výroba, použití

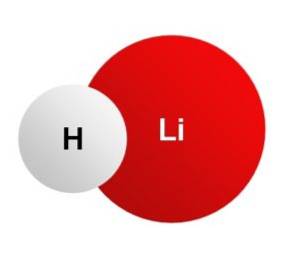
The hydrid lithný je to krystalická anorganická pevná látka, jejíž chemický vzorec je LiH. Je to nejlehčí anorganická sůl, její molekulová hmotnost je pouze 8 g / mol. Vzniká spojením lithium-iontového Li+ a hydridový ion H-. Oba jsou spojeny iontovou vazbou.
LiH má vysokou teplotu tání. Snadno reaguje s vodou a při reakci se vytváří plynný vodík. Lze jej získat reakcí mezi roztaveným kovem lithia a plynným vodíkem. Je široce používán v chemických reakcích k získání dalších hydridů.
LiH se používá k ochraně před nebezpečným zářením, jako je záření v jaderných reaktorech, tj. Záření ALPHA, BETA, GAMMA, protony, rentgenové záření a neutrony..
Rovněž bylo navrženo pro ochranu materiálů v kosmických raketách poháněných jaderným tepelným pohonem. Provádějí se dokonce studie, které mají sloužit jako ochrana člověka před kosmickým zářením během budoucích cest na planetu Mars..
Rejstřík článků
- 1 Struktura
- 2 Názvosloví
- 3 Vlastnosti
- 3.1 Fyzický stav
- 3,2 Molekulová hmotnost
- 3.3 Teplota tání
- 3.4 Bod varu
- 3.5 Teplota samovznícení
- 3.6 Hustota
- 3.7 Rozpustnost
- 3.8 Další vlastnosti
- 4 Získání
- 5 Používejte jako ochranný štít proti nebezpečnému záření
- 5.1 - V jaderných reaktorech
- 5.2 - V kosmických systémech jaderného tepelného pohonu
- 5.3 - V ochraně před kosmickým zářením
- 6 Použití jako prostředek bezpečného skladování a přepravy vodíku
- 7 Použití v chemických reakcích
- 8 Reference
Struktura
Vodík v hydridu lithném má záporný náboj H-, protože odečetl elektron od kovu, který je ve formě Li iontu+.
Elektronová konfigurace kationtu Li+ je: [He] 1sdva což je velmi stabilní. A elektronová struktura hydridového aniontu H- je: 1 sdva, což je také velmi stabilní.
Kation a anion jsou spojeny elektrostatickými silami.
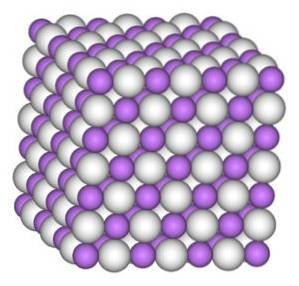
Krystal lithia hydridu má stejnou strukturu jako chlorid sodný NaCl, to znamená kubickou krystalickou strukturu.
Nomenklatura
- Lithium hydrid
- LiH
Vlastnosti
Fyzický stav
Bílá nebo bezbarvá krystalická pevná látka. Komerční LiH může být modrošedý kvůli přítomnosti malého množství kovového lithia..
Molekulární váha
8 g / mol
Bod tání
688 ° C
Bod varu
Rozkládá se při 850 ° C.
teplota samovznícení
200 ° C
Hustota
0,78 g / cm3
Rozpustnost
Reaguje s vodou. Je nerozpustný v etherech a uhlovodících.
Další vlastnosti
Lithium hydrid je mnohem stabilnější než hydridy jiných alkalických kovů a lze ho roztavit bez rozkladu..
Není ovlivněn kyslíkem, pokud je zahříván na teplotu pod červenou. Rovněž není ovlivněn chlorem Cldva a kyselina chlorovodíková HC1.
Kontakt LiH s teplem a vlhkostí způsobuje exotermickou reakci (generuje teplo) a vývoj vodíku Hdva a hydroxid lithný LiOH.
Může tvořit jemný prach, který může explodovat při kontaktu s plameny, teplem nebo oxidačními materiály. Nesmí přijít do styku s oxidem dusným nebo kapalným kyslíkem, protože může explodovat nebo vznítit.
Při vystavení světlu ztmavne.
Získávání
Hydrid lithný byl získán v laboratoři reakcí mezi roztaveným kovem lithia a plynným vodíkem při teplotě 973 K (700 ° C).
2 Li + Hdva → 2 LiH
Dobré výsledky jsou dosaženy, když je zvýšen exponovaný povrch roztaveného lithia a když je snížena doba sedimentace LiH. Je to exotermická reakce.
Používejte jako ochranný štít proti nebezpečnému záření
LiH má řadu charakteristik, díky nimž je atraktivní pro použití jako ochrana lidí v jaderných reaktorech a vesmírných systémech. Zde jsou některé z těchto charakteristik:
- Má vysoký obsah vodíku (12,68% hmotnostních H) a vysoký počet atomů vodíku na jednotku objemu (5,85 x 1022 H atomy / cm3).
- Jeho vysoká teplota tání umožňuje použití v prostředí s vysokou teplotou bez roztavení.
- Má nízký disociační tlak (~ 20 torr při teplotě tání), což umožňuje roztavení a zmrazení materiálu bez degradace za nízkého tlaku vodíku..
- Má nízkou hustotu, takže je atraktivní pro použití v kosmických systémech..
- Jeho nevýhodami jsou však nízká tepelná vodivost a špatné mechanické vlastnosti. To však nezmenšilo jeho použitelnost.
- Části LiH, které slouží jako štíty, se vyrábějí lisováním za tepla nebo za studena a tavením a litím do forem. I když se dává přednost této poslední formě.
- Při pokojové teplotě jsou díly chráněny před vodou a vodní párou a při vysokých teplotách malým přetlakem vodíku v uzavřené nádobě.
- V jaderných reaktorech
V jaderných reaktorech existují dva typy záření:
Přímo ionizující záření
Jsou to vysoce energetické částice, které přenášejí elektrický náboj, jako jsou alfa (α) a beta (β) částice a protony. Tento typ záření velmi silně interaguje s materiály štítů a způsobuje ionizaci interakcí s elektrony atomů materiálů, kterými procházejí..
Nepřímo ionizující záření
Jsou to neutrony, gama paprsky (γ) a rentgenové paprsky, které pronikají a vyžadují masivní ochranu, protože zahrnují emisi sekundárně nabitých částic, které způsobují ionizaci..

Podle některých zdrojů je LiH účinný při ochraně materiálů a lidí před těmito typy záření.
- V kosmických systémech jaderného tepelného pohonu
LiH byl nedávno vybrán jako potenciální moderátor a materiál chránící před jaderným zářením pro jaderné tepelné pohonné systémy kosmických lodí s velmi dlouhou plavbou..

Jeho nízká hustota a vysoký obsah vodíku umožňují efektivní snížení hmotnosti a objemu jaderného reaktoru..
- Na ochranu před kosmickým zářením
Vystavení kosmickému záření je nejdůležitějším rizikem pro lidské zdraví v budoucích meziplanetárních průzkumných misích.
V hlubokém vesmíru budou astronauti vystaveni celému spektru galaktických kosmických paprsků (ionty s vysokou energií) a událostem vymrštění slunečních částic (protony)..
Nebezpečí radiační expozice je umocněno délkou misí. Kromě toho je třeba vzít v úvahu také ochranu míst, která průzkumníci obývají.

V tomto duchu studie provedená v roce 2018 ukázala, že mezi testovanými materiály poskytuje LiH největší snížení záření na gram na cmdva, je tedy jedním z nejlepších kandidátů na ochranu před kosmickým zářením. Tyto studie však musí být prohloubeny.
Používejte jako bezpečné skladovací a přepravní médium pro vodík
Získávání energie z Hdva Je to něco, co bylo studováno několik desítek let a již našlo uplatnění při nahrazování fosilních paliv v dopravních prostředcích.
Hdva mohou být použity v palivových článcích a přispívají ke snížení produkce COdva a žádnáX, čímž se zabrání skleníkovým efektům a znečištění. Efektivní systém pro skladování a přepravu H však dosud nebyl nalezendva bezpečně, lehký, kompaktní nebo malý, rychle skladovatelný a uvolnit Hdva stejně rychle.
Lithium hydrid LiH je jedním z alkalických hydridů, který má nejvyšší skladovací kapacitu pro Hdva (12,7% hmotn. H). Uvolněte Hdva hydrolýzou podle následující reakce:
LiH + HdvaO → LiOH + Hdva
LiH dodává 0,254 kg vodíku na každou kg LiH. Kromě toho má vysokou úložnou kapacitu na jednotku objemu, což znamená, že je lehký a je kompaktním médiem pro skladování Hdva.

LiH se navíc tvoří snadněji než jiné hydridy alkalických kovů a je chemicky stabilní při okolních teplotách a tlacích. LiH lze přepravovat od výrobce nebo dodavatele k uživateli. Poté se hydrolýzou LiH vytvoří Hdva a toto se používá bezpečně.
Vytvořený hydroxid lithný LiOH může být vrácen dodavateli, který regeneruje lithium elektrolýzou a poté znovu produkuje LiH..
LiH byl také úspěšně studován pro použití ve spojení s borovaným hydrazinem pro stejný účel..
Použití v chemických reakcích
LiH umožňuje syntézu komplexních hydridů.
Používá se například k přípravě triethylborohydridu lithného, který je silným nukleofilem při vytěsňovacích reakcích organických halogenidů..
Reference
- Sato, Y. a Takeda, O. (2013). Systém skladování a přepravy vodíku prostřednictvím hydridu lithného pomocí technologie roztavené soli. V Chemii roztavených solí. Kapitola 22, stránky 451-470. Obnoveno ze sciencedirect.com.
- NÁS. Národní lékařská knihovna. (2019). Lithium hydrid. Obnoveno z: pubchem.ncbi.nlm.nih.gov.
- Wang, L. a kol. (2019). Výzkum dopadu tepelně-jaderného účinku hydridu lithného na reaktivitu reaktoru s částicemi s jaderným pohonem. Annals of Nuclear Energy 128 (2019) 24-32. Obnoveno ze sciencedirect.com.
- Cotton, F. Albert a Wilkinson, Geoffrey. (1980). Pokročilá anorganická chemie. Čtvrté vydání. John Wiley & Sons.
- Giraudo, M. a kol. (2018). Akcelerátorové testy účinnosti stínění různých materiálů a vícevrstev pomocí vysoce energetických lehkých a těžkých iontů. Radiační výzkum 190; 526-537 (2018). Obnoveno z ncbi.nlm.nih.gov.
- Welch, F.H. (1974). Lithium hydrid: Materiál stínící vesmírný věk. Nuclear Engineering and Design 26, 3, únor 1974, strany 444-460. Obnoveno ze sciencedirect.com.
- Simnad, M. T. (2001). Jaderné reaktory: stínící materiály. In Encyclopedia of Materials: Science and Technology (Second Edition). Stránky 6377-6384. Obnoveno ze sciencedirect.com.
- Hügle, T. a kol. (2009). Hydrazine Borane: Slibný materiál pro skladování vodíku. J. Am. Chem. Soc. 2009, 131, 7444-7446. Obnoveno z pubs.acs.org.



Zatím žádné komentáře