
Vlastnosti hydridu sodného (NaH), reaktivita, nebezpečí, použití

The hydrid sodný Je to anorganická sloučenina vzorce NaH. Má iontovou vazbu mezi sodíkem a hydridem. Jeho struktura je znázorněna na obrázku 1. Reprezentuje solné hydridy, což znamená, že se jedná o hydrid podobný soli, složený z iontů Na + a H-, na rozdíl od více molekulárních hydridů, jako je boran, methan, amoniak a voda..
Krystalová struktura má koordinační číslo 6, kde je každá molekula sodíku obklopena 8 hydridovými ionty s oktaedrickým tvarem a je znázorněna na obrázku 2 (Mark Winter [The University of Sheffield and WebElements Ltd, 1993-2016).
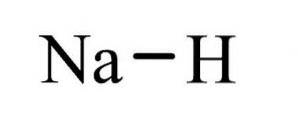
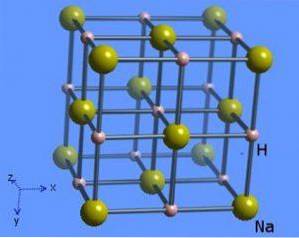
Sloučenina se připravuje přímou reakcí mezi sodíkem a plynným vodíkem (hydrid sodný vzorec - použití hydridu sodného, vlastnosti, struktura a vzorec, 2005-2017) následovně:
H2 + 2Na → 2NaH
Hydrid sodný se komerčně prodává ve formě disperze v 60% hmotn./hmotn. (Hmotnostní procento) v minerálním oleji pro bezpečnou manipulaci (SODIUM HYDRIDE, n.d.).
Rejstřík článků
- 1 Fyzikální a chemické vlastnosti hydridu sodného
- 2 Reaktivita a nebezpečí
- 3 použití
- 4 Odkazy
Fyzikální a chemické vlastnosti hydridu sodného
Hydrid sodný je bílá pevná látka, pokud je čistá, i když má obvykle šedou nebo stříbrnou barvu. Jeho vzhled je znázorněn na obrázku 3.

NaH má molekulovou hmotnost 23,99771 g / mol, hustotu 1,396 g / ml a teplotu tání 800 ° C (Royal Society of Chemistry, 2015). Je nerozpustný v amoniaku, benzenu, tetrachlormethanu a sirouhlíku (National Center for Biotechnology Information, n.d.).
Sloučenina je extrémně nestabilní. Čistý NaH se může snadno vznítit na vzduchu. Při kontaktu s vodou přítomnou ve vzduchu uvolňuje vysoce hořlavý vodík.
Když je NaH na vzduchu a ve vlhku, snadno hydrolyzuje na silnou korozivní bázi hydroxidu sodného (NaOH) na základě reakce:
NaH + H2O → NaOH + H2
V této reakci je vidět, že hydrid sodný se chová jako báze. To je způsobeno elektronegativitou.
Sodík má výrazně nižší elektronegativitu (≈1,0) než vodík (≈2,1), což znamená, že vodík přitahuje elektronovou hustotu směrem k sobě a pohybuje se od sodíku za vzniku kationu sodíku a anionhydridu.
Aby sloučenina mohla být Bronstedovou kyselinou, musí oddělit elektronovou hustotu vodíku, to znamená připojit ji k elektronegativnímu atomu, jako je kyslík, fluor, dusík atd. Teprve potom jej lze formálně popsat jako H + a lze jej jako takový disociovat.
Hydrid je mnohem lépe popsán jako H- a má volný elektronový pár. Jako takový je to Bronstedova báze, ne kyselina. Ve skutečnosti, pokud rozšíříte Brønstedovu definici kyselina / báze tak, jak to udělal Lewis, dojde k závěru, že sodík (Na +) je zde kyselý druh..
Z Bronstedova acidobazického reakčního produktu báze H- a kyseliny H + se stane H2. Protože se kyselý vodík extrahuje přímo z vody, může plynný vodík bublat a vytěsňovat rovnováhu, i když reakce není termodynamicky upřednostňována..
Mohou zůstat OH- ionty, které lze zapsat zbytkem kationu Na + za vzniku hydroxidu sodného (Proč je pevný hydrid sodný bází a ne kyselinou, když reaguje s vodou?, 2016).
Reaktivita a nebezpečí
Sloučenina je silné redukční činidlo. Útočí na SiO2 ve skle. Zapálí při kontaktu s plynnými F2, Cl2, Br2 a I2 (poslední při teplotách nad 100 ° C), zejména za přítomnosti vlhkosti, za vzniku HF, HCl, HBr a HI.
Reaguje se sírou za vzniku Na2S a H2S. Může výbušně reagovat s dimethylsulfoxidem. Intenzivně reaguje s acetylenem, dokonce i při -60 ° C. Je spontánně hořlavý ve fluoru.
Zahájí polymerační reakci v ethyl-2,2,3-trifluorpropionátu, takže se ester prudce rozloží. Přítomnost diethylsukcinátu a ethyl trifluoracetátu v reakci způsobila výbuchy (SODIUM HYDRIDE, 2016).
Hydrid sodný je považován za žíravý pro kůži nebo oči kvůli možnému vzniku žíravých vedlejších produktů při reakci s vodou..
V případě kontaktu s očima je vypláchněte velkým množstvím vody pod víčky po dobu nejméně 15 minut a okamžitě vyhledejte lékařskou pomoc..
V případě kontaktu s pokožkou okamžitě kartáčujte a opláchněte postižené místo vodou. Pokud podráždění přetrvává, vyhledejte lékařskou pomoc..
Zdraví škodlivý při požití v důsledku reakce na vodu. Nevyvolávejte zvracení. Okamžitě vyhledejte lékařskou pomoc a přemístěte postiženého do zdravotnického zařízení..
Olejová disperze hydridu sodného není prášek. Reagující materiál však může vydávat jemnou žíravou mlhu. V případě vdechnutí vypláchněte ústa vodou a přemístěte postiženého na čerstvý vzduch. Vyhledejte lékařskou pomoc (Rhom a Hass Inc., 2007).
Aplikace
Hlavní použití hydridu sodného je provádění kondenzačních a alkylačních reakcí, které se vyvíjejí tvorbou karbaniontu (katalyzovaného bází).
Hydrid sodný v oleji připomíná sodné a kovové alkoholáty sodíku v jeho schopnosti fungovat jako deprotonační činidlo v esteru acetoctové, Claisen, Stobbe, kondenzace Dieckmann a další související reakce. Oproti jiným kondenzačním činidlům má výrazné výhody v tom, že:
- Jedná se o silnější základnu, která vede k přímější deprotonaci.
- Není potřeba žádný přebytek.
- Vyprodukovaný H2 poskytuje míru rozsahu reakce.
- Vedlejší reakce, jako jsou redukce, jsou vyloučeny.
Alkylace aromatických a heterocyklických aminů, jako je 2-aminopyridin a fenothiazin, lze snadno dosáhnout ve vysokém výtěžku za použití směsí toluen-methylformamid. Koncentrace dimetylformamidu je proměnná používaná k řízení reakční rychlosti (HINCKLEY, 1957).
Bylo navrženo použití hydridu sodného pro skladování vodíku pro použití ve vozidlech s palivovými články, přičemž hydrid je uzavřen v plastových granulích, které jsou drceny v přítomnosti vody, aby se uvolnil vodík..
Reference
- HINCKLEY, M. D. (1957). Výroba, manipulace a použití hydridu sodného. Advances in Chemistry, sv. 19, 106-117.
- Mark Winter [The University of Sheffield and WebElements Ltd, U. (1993–2016). Sodík: hydrid sodný. Citováno z WebElements: webelements.com.
- Národní centrum pro biotechnologické informace. (s.f.). Složená databáze PubChem; CID = 24758. Citováno z PubChem: pubchem.ncbi.nlm.nih.gov.
- Rhom and Hass Inc. (2007, prosinec). Hydrid sodný 60% disperze v oleji. Obnoveno z dow.com.
- Royal Society of Chemistry. (2015). Hydrid sodný. Citováno z ChemSpider: chemspider.com.
- HYDRID SODNÝ. (2016). Citováno z cameochemicals: cameochemicals.noaa.gov.
- Vzorec hydridu sodného - použití, vlastnosti, struktura a vzorec hydridu sodného. (2005-2017). Citováno z Softschools.com: softschools.com.
- HYDRID SODNÝ. (s.f.). Obnoveno z chemicalland21: chemicalland21.com.
- Proč je pevný hydrid sodný zásadou a ne kyselinou, když reaguje s vodou? (2016, 20. dubna). Citováno z stackexchange: chemistry.stackexchange.com.



Zatím žádné komentáře