
Struktura hydroxidu rtuti, vlastnosti, použití, rizika

The hydroxid rtuťnatý Je to anorganická sloučenina, ve které má kovová rtuť (Hg) oxidační číslo 2+. Jeho chemický vzorec je Hg (OH)dva. Tento druh však za normálních podmínek dosud nebyl získán v pevné formě..
Hydroxid rtuťnatý nebo hydroxid rtuťnatý je krátkodobý přechodný meziprodukt při tvorbě oxidu rtuťnatého HgO v alkalickém roztoku. Ze studií provedených v roztocích oxidu rtuťnatého HgO lze odvodit, že Hg (OH)dva je to slabá základna. Jiné druhy, které jej doprovázejí, jsou HgOH+ a Hgdva+.

Navzdory tomu, že nemůže být vysrážen ve vodném roztoku, Hg (OH)dva Bylo získáno fotochemickou reakcí rtuti s vodíkem a kyslíkem při velmi nízkých teplotách. Bylo také získáno ve formě koprecipitátu spolu s Fe (OH)3, kde přítomnost halogenidových iontů ovlivňuje pH, při kterém dochází ke srážení.
Vzhledem k tomu, že jej nebylo možné snadno získat čistě na laboratorní úrovni, nebylo možné pro tuto sloučeninu najít žádné použití ani určit rizika jejího použití. Lze však odvodit, že představuje stejná rizika jako ostatní sloučeniny rtuti.
Rejstřík článků
- 1 Struktura molekuly
- 2 Elektronická konfigurace
- 3 Názvosloví
- 4 Vlastnosti
- 4.1 Molekulová hmotnost
- 4.2 Chemické vlastnosti
- 5 Získání
- 5.1 Čistý hydroxid rtuťnatý
- 5.2 Společné srážení s hydroxidem železitým
- 6 použití
- 7 Nedávné studie
- 8 Rizika
- 9 Odkazy
Struktura molekuly
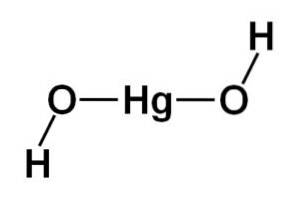
Struktura hydroxidu rtuťnatého Hg (OH)dva je založen na lineární střední části tvořené atomem rtuti se dvěma atomy kyslíku po stranách.
Atomy vodíku jsou připojeny k této centrální struktuře, každý vedle každého kyslíku, který se volně otáčí kolem každého kyslíku. Mohlo by to být znázorněno jednoduchým způsobem takto:
Elektronická konfigurace
Elektronická struktura kovové rtuti Hg je následující:
[Xe] 5d10 6sdva
kde [Xe] je elektronová konfigurace xenonu vzácného plynu.
Při pozorování této elektronové struktury se odvozuje, že nejstabilnějším oxidačním stavem rtuti je ten, ve kterém jsou ztraceny 2 elektrony vrstvy 6.s.
V hydroxidu rtuťnatém Hg (OH)dva, atom rtuti (Hg) je v oxidačním stavu 2+. Proto v Hg (OH)dva rtuť má následující elektronickou konfiguraci:
[Xe] 5d10
Nomenklatura
- Hydroxid rtuťnatý
- Hydroxid rtuťnatý
- Rtuťnatý dihydroxid
Vlastnosti
Molekulární váha
236,62 g / mol
Chemické vlastnosti
Podle konzultovaných informací je možné, že Hg (OH)dva být přechodnou sloučeninou při tvorbě HgO v alkalickém vodném prostředí.
Přidání hydroxylových iontů (OH-) na vodný roztok iontů rtuti Hgdva+ vede ke srážení žluté pevné látky oxidu rtuťnatého HgO, z toho Hg (OH)dva je dočasný nebo dočasný zaměstnanec.

Ve vodném roztoku Hg (OH)dva Je to velmi krátkodobý meziprodukt, protože rychle uvolňuje molekulu vody a vysráží se pevný HgO.
Ačkoli nebylo možné vysrážet hydroxid rtuťnatý Hg (OH)dva, oxid rtuti (II) HgO je poněkud rozpustný ve vodě a tvoří roztok druhů zvaných „hydroxidy“.
Tyto druhy ve vodě zvané „hydroxidy“ jsou slabé báze ai když se někdy chovají jako amfoterní, obecně Hg (OH)dva je zásaditější než kyselina.
Když se HgO rozpouští v HClO4 studie naznačují přítomnost rtuťnatého iontu Hgdva+, monohydroxymertuťnatý ion HgOH+ a hydroxid rtuťnatý Hg (OH)dva.
Rovnováhy, ke kterým dochází v takových vodných roztocích, jsou následující:
Hgdva+ + HdvaO ⇔ HgOH+ + H+
HgOH+ + HdvaO ⇔ Hg (OH)dva + H+
V alkalických roztocích NaOH vzniká druh Hg (OH)3-.
Získávání
Čistý hydroxid rtuťnatý
Hydroxid rtuti (II) Hg (OH)dva Nelze jej získat ve vodném roztoku, protože při přidání alkálie k roztoku iontů rtuti Hgdva+, vysráží se žlutý oxid rtuťnatý HgO.
Některým vědcům se však poprvé v roce 2005 podařilo získat hydroxid rtuťnatý Hg (OH)dva pomocí rtuťové obloukové lampy, vycházející z prvku rtuti Hg, vodíku Hdva a kyslík Odva.

Reakce je fotochemická a byla prováděna v přítomnosti pevného neonu, argonu nebo deuteria při velmi nízkých teplotách (kolem 5 K = 5 stupňů Kelvina). Důkaz tvorby sloučeniny byl získán IR (infračerveným) spektrem absorpce světla.
Hg (OH)dva takto připravený je za podmínek zkušeností velmi stabilní. Odhaduje se, že fotochemická reakce probíhá přes meziprodukt O-Hg-O ke stabilní molekule H-O-Hg-O-H.
Koprecipitace s hydroxidem železitým
Pokud se rozpustí síran rtuťnatý HgSO4 a síran železitý Fedva(SW4)3 v kyselém vodném roztoku a pH se začíná zvyšovat přidáním roztoku hydroxidu sodného NaOH, po odstátí se vytvoří pevná látka, která je považována za ko-sraženinu Hg (OH)dva a Fe (OH)3.
Bylo zjištěno, že tvorba Hg (OH)dva je kritickým krokem v této společné srážení s Fe (OH)3.
Tvorba Hg (OH)dva ve sraženině Fe (OH)3-Hg (OH)dva silně závisí na přítomnosti iontů, jako je fluorid, chlorid nebo bromid, na jejich specifické koncentraci a na pH roztoku.
V přítomnosti fluoridu (F.-) při pH vyšším než 5 koprecipitace Hg (OH)dva s Fe (OH)3 není to ovlivněno. Ale při pH 4 tvorba komplexů mezi Hgdva+ a F- interferuje s ko-srážením Hg (OH)dva.
V případě přítomnosti chloridu (Cl-), společné srážení Hg (OH)dva dochází při pH 7 nebo vyšším, tj. výhodně v alkalickém prostředí.
Když bromid (Br-), společné srážení Hg (OH)dva dochází při ještě vyšším pH, tj. při pH nad 8,5, nebo více zásaditém než u chloridu.
Aplikace
Z přehledu zdrojů dostupných informací lze odvodit, že hydroxid rtuťnatý Hg (OH)dva, Jelikož se jedná o sloučeninu, která dosud nebyla komerčně připravena, nemá žádná známá použití.
Nedávné studie
Pomocí výpočetních simulačních technik v roce 2013 byly studovány strukturní a energetické charakteristiky související s hydratací Hg (OH).dva v plynném stavu.
Energie koordinace a solvatace kovového ligandu byly vypočteny a porovnány změnou stupně hydratace Hg (OH)dva.
Mimo jiné bylo zjištěno, že zřejmě teoretický oxidační stav je 1+ místo předpokládaných 2+ obvykle přiřazených pro Hg (OH)dva.
Rizika
Ačkoli Hg (OH)dva jako takový nebyl izolován v dostatečném množství, a proto nebyl komerčně používán, jeho specifická rizika nebyla stanovena, ale lze z něj odvodit, že představuje stejná rizika jako zbytek solí rtuti.
Může být toxický pro nervový systém, trávicí systém, kůži, oči, dýchací systém a ledviny..
Vdechnutí, požití nebo kontakt s pokožkou sloučenin rtuti může způsobit poškození, od jiných příznaků, jako je podráždění očí a kůže, nespavost, bolesti hlavy, třes, poškození střevního traktu, ztráta paměti, selhání ledvin a další příznaky..
Merkur byl mezinárodně uznáván jako znečišťující látka. Většina sloučenin rtuti, které přicházejí do styku s prostředím, je methylována bakteriemi přítomnými v půdách a sedimentech a vytváří metylortuť.
Tato sloučenina se bioakumuluje v živých organismech a přechází z půdy do rostlin a odtud do zvířat. Ve vodním prostředí je přenos ještě rychlejší a v krátké době přechází z velmi malých na velké druhy.
Methylrtuť má toxický účinek na živé bytosti, zejména na lidi, kteří ji přijímají prostřednictvím potravinového řetězce.
Při požití je obzvláště škodlivé pro malé děti a plody těhotných žen, protože je to neurotoxin a může poškodit mozek a nervový systém při tvorbě a růstu..
Reference
- Cotton, F. Albert a Wilkinson, Geoffrey. (1980). Pokročilá anorganická chemie. Čtvrté vydání. John Wiley & Sons.
- Wang, Xuefeng a Andrews, Lester (2005). Infračervené spektrum Hg (OH)dva v Solid Neon a Argon. Anorganic Chemistry, 2005, 44, 108-113. Obnoveno z pubs.acs.org.
- Amaro-Estrada, J.I., et al. (2013). Vodné rozpouštění Hg (OH)dva: Studie funkční teorie energetické a dynamické hustoty Hg (OH)dva-(HdvaNEBO)n (n = 1-24) Struktury. J. Phys. Chem. A 2013, 117, 9069-9075. Obnoveno z pubs.acs.org.
- Inoue, Yoshikazu a Munemori, Makoto. (1979). Koprecipitace rtuti (II) s hydroxidem železitým (III). Věda o životním prostředí a technologie. Svazek 13, číslo 4, duben 1979. Obnoveno z pubs.acs.org.
- Chang, L.W., et al. (2010). Toxikologie nervového systému a chování. In Comprehensive Toxicology. Obnoveno ze sciencedirect.com.
- Haney, Alan a Lipsey, Richard L. (1973). Akumulace a účinky hydroxidu metylortuti v suchozemském potravinovém řetězci za laboratorních podmínek. Environ. Znečištění. (5) (1973), str. 305-316. Obnoveno ze sciencedirect.com.



Zatím žádné komentáře