
Vzorec, vlastnosti a použití amonného iontu (NH4 +)

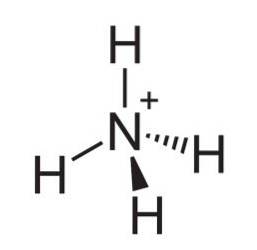
The amonný ion je kladně nabitý polyatomový kation, jehož chemický vzorec je NH4+. Molekula není plochá, ale má tvar čtyřstěnu. Čtyři atomy vodíku tvoří čtyři rohy.
Amoniakální dusík má nesdílený pár elektronů schopných přijmout proton (Lewisovu bázi), proto je amonný iont vytvořen protonací amoniaku podle reakce: NH3 + H+ → NH4+
Název amonium se také dává substituovaným aminům nebo substituovaným amoniovým kationtům. Například methylamoniumchlorid je iontová sůl vzorce CH3NH4Cl, kde je chloridový iont vázán na methylamin.
Amonný iont má vlastnosti velmi podobné těžším alkalickým kovům a je často považován za blízkého příbuzného. Očekává se, že amonium se bude chovat jako kov při velmi vysokých tlacích, jako například uvnitř plynných obřích planet jako Uran a Neptun..
Amonný iont hraje důležitou roli při syntéze bílkovin v lidském těle. Stručně řečeno, všechno živé potřebuje proteiny, které jsou složeny z asi 20 různých aminokyselin. Zatímco rostliny a mikroorganismy mohou syntetizovat většinu aminokyselin z dusíku v atmosféře, zvířata ne..
U lidí nelze některé aminokyseliny syntetizovat vůbec a musí se konzumovat jako esenciální aminokyseliny.
Jiné aminokyseliny však mohou být syntetizovány mikroorganismy v gastrointestinálním traktu pomocí amonných iontů. Tato molekula je tedy klíčovou postavou v cyklu dusíku a v syntéze bílkovin..
Rejstřík článků
- 1 Vlastnosti
- 1.1 Rozpustnost a molekulová hmotnost
- 1.2 Vlastnosti na bázi kyselin
- 1.3 Amonné soli
- 2 použití
- 3 Odkazy
Vlastnosti
Rozpustnost a molekulová hmotnost
Amonný iont má molekulovou hmotnost 18,039 g / mol a rozpustnost 10,2 mg / ml vody (National Center for Biotechnology Information, 2017). Rozpuštěním amoniaku ve vodě vznikne podle reakce amonný iont:
NH3 + HdvaO → NH4+ + Ach-
To zvyšuje koncentraci hydroxylu v médiu zvýšením pH roztoku (Royal Society of Chemistry, 2015).
Vlastnosti kyselé báze
Amonný iont má pKb 9,25. To znamená, že při pH vyšším než tato hodnota bude mít kyselé chování a při nižším pH bude mít zásadité chování..
Například když rozpouští amoniak v kyselině octové (pKa = 4,76), volný elektronový pár dusíku odebírá proton z média a zvyšuje koncentraci hydroxidových iontů podle rovnice:
NH3 + CH3COOH ⇌ NH4+ + CH3VRKAT-
Avšak v přítomnosti silné báze, jako je hydroxid sodný (pKa = 14,93), získá amonný iont proton do média podle reakce:
NH4+ + NaOH ⇌ NH3 + Na+ + HdvaNEBO
Závěrem lze říci, že při pH nižším než 9,25 bude dusík protonován, zatímco při pH vyšším než tato hodnota bude deprotonován. To je nanejvýš důležité pro pochopení titračních křivek a pochopení chování látek, jako jsou aminokyseliny..
Amonné soli
Jednou z nejcharakterističtějších vlastností amoniaku je jeho schopnost kombinovat přímo s kyselinami za vzniku solí v závislosti na reakci:
NH3 + HX → NH4X
S kyselinou chlorovodíkovou tedy tvoří chlorid amonný (NH4Cl); S kyselinou dusičnou, dusičnanem amonným (NH4NE3), s kyselinou uhličitou vytvoří uhličitan amonný ((NH4)dvaCO3) atd.
Ukázalo se, že dokonale suchý amoniak se nebude kombinovat s dokonale suchou kyselinou chlorovodíkovou, přičemž k vyvolání reakce je nezbytná vlhkost (VIAS Encyclopedia, 2004).
Většina jednoduchých amonných solí je velmi snadno rozpustná ve vodě. Výjimkou je hexachloroplatinát amonný, jehož tvorba se používá jako zkouška na amonium. Soli dusičnanu amonného a zejména chloristanu jsou vysoce výbušné, v těchto případech je amonium redukčním činidlem.
V neobvyklém procesu tvoří amonné ionty amalgám. Tyto druhy se připravují elektrolýzou amonného roztoku za použití rtuťové katody. Tento amalgám se nakonec rozkládá a uvolňuje amoniak a vodík (Johnston, 2014).
Jednou z nejběžnějších amonných solí je hydroxid amonný, což je jednoduše amoniak rozpuštěný ve vodě. Tato sloučenina je velmi běžná a přirozeně se vyskytuje v životním prostředí (ve vzduchu, vodě a půdě) a ve všech rostlinách a zvířatech, včetně lidí..
Aplikace
Amonium je důležitým zdrojem dusíku pro mnoho druhů rostlin, zejména těch, které rostou v hypoxických půdách. Je však také toxický pro většinu druhů plodin a zřídka se používá jako jediný zdroj dusíku (Database, Human Metabolome, 2017).
Dusík (N), vázaný na bílkoviny v mrtvé biomase, je spotřebován mikroorganismy a přeměněn na amonné ionty (NH4 +), které mohou být přímo absorbovány kořeny rostlin (např. Rýže).
Amonné ionty se obvykle převádějí na nitritové ionty (NO2-) bakteriemi nitrosomonas, následovanou druhou konverzí na dusičnany (NO3-) bakteriemi Nitrobacter..
Tři hlavní zdroje dusíku používané v zemědělství jsou močovina, amonium a dusičnany. Biologická oxidace amonia na dusičnan je známá jako nitrifikace. Tento proces zahrnuje několik kroků a je zprostředkován obligátními aerobními, autotrofními bakteriemi..
V zatopených půdách je oxidace NH4 + omezena. Močovina se štěpí enzymem ureázou nebo se chemicky hydrolyzuje na amoniak a CO2.
V kroku amonifikace se amoniak přeměňuje amonizujícími bakteriemi na amonný iont (NH4 +). V dalším kroku je amonium přeměněno nitrifikačními bakteriemi na dusičnany (nitrifikace).
Tato vysoce mobilní forma dusíku je nejčastěji absorbována kořeny rostlin a mikroorganismy v půdě..
K uzavření cyklu dusíku se plynný dusík v atmosféře přeměňuje na dusík z biomasy bakteriemi Rhizobium, které žijí v kořenových tkáních luštěnin (například vojtěšky, hrachu a fazolí) a luštěnin (jako jelše). A sinic a Azotobacter (Sposito, 2011).
Prostřednictvím amoniaku (NH4 +) mohou vodní rostliny absorbovat a zabudovat dusík do proteinů, aminokyselin a dalších molekul. Vysoké koncentrace amoniaku mohou zvýšit růst řas a vodních rostlin.
Hydroxid amonný a další amonné soli jsou široce používány při zpracování potravin. Předpisy Úřadu pro kontrolu potravin a léčiv (FDA) uvádějí, že hydroxid amonný je bezpečný („obecně uznávaný jako bezpečný“ nebo GRAS) jako droždí, látka regulující pH a povrchová látka..
Seznam potravin, ve kterých se hydroxid amonný používá jako přímá přísada do potravin, je rozsáhlý a zahrnuje pečivo, sýry, čokolády, jiné cukrářské výrobky (např. Cukrovinky) a pudinky. Hydroxid amonný se také používá jako antimikrobiální látka v masných výrobcích.
Amoniak v jiných formách (např. Síran amonný, alginát amonný) se používá do koření, izolátů sójových bílkovin, občerstvení, džemů a želé a nealkoholických nápojů (sdružení PNA dusičnan draselný, 2016).
Měření amoniaku se používá v testu RAMBO, což je zvláště užitečné při diagnostice příčiny acidózy (ID testu: RAMBO Ammonium, Random, Urine, S.F.). Ledviny regulují vylučování kyselin a systémovou acidobazickou rovnováhu.
Změna množství amoniaku v moči je pro ledviny důležitým způsobem. Měření hladiny amoniaku v moči může poskytnout pohled na příčinu narušení acidobazické rovnováhy u pacientů..
Hladina amoniaku v moči může také poskytnout mnoho informací o denní produkci kyseliny u daného pacienta. Vzhledem k tomu, že většina kyselé dávky jedince pochází z požitého proteinu, je množství amoniaku v moči dobrým ukazatelem příjmu bílkovin ve stravě.
Měření amoniaku v moči může být zvláště užitečné pro diagnostiku a léčbu pacientů s ledvinovými kameny:
- Vysoká hladina amoniaku v moči a nízké pH v moči naznačují pokračující gastrointestinální ztráty. Tito pacienti jsou ohroženi kameny kyseliny močové a oxalátu vápenatého..
- Trochu amoniaku v moči a vysoké pH moči naznačuje renální tubulární acidózu. U těchto pacientů existuje riziko vzniku kamenů obsahujících fosforečnan vápenatý.
- Pacienti s kameny oxalátu vápenatého a fosforečnanu vápenatého jsou často léčeni citrátem, aby zvýšili hladinu citrátu v moči (přirozený inhibitor růstu oxalátu vápenatého a krystalů fosforečnanu vápenatého)..
Jelikož je však citrát metabolizován na hydrogenuhličitan (báze), může tento lék také zvyšovat pH moči. Pokud je pH moči při léčbě citrátem příliš vysoké, může se nechtěně zvýšit riziko vzniku kamenů obsahujících fosforečnan vápenatý..
Monitorování moči na amoniak je jedním ze způsobů, jak titrovat dávku citrátu a vyhnout se tomuto problému. Dobrá počáteční dávka citrátu je přibližně polovina vylučování amonia v moči (v mEq každého).
Vliv této dávky na hodnoty amonia, citrátu a pH moči lze monitorovat a dávku citrátu upravit na základě odpovědi. Pokles amoniaku v moči by měl indikovat, zda je aktuální citrát dostatečný k částečnému (ale ne úplnému) vyrovnání denního zatížení kyselinou daného pacienta..
Reference
- Databáze, lidský metabolome. (2017, 2. března). Zobrazuje se metabocard pro amonium. Obnoveno z: hmdb.ca.
- Johnston, F. J. (2014). Amonná sůl. získaný z accessscience: accessscience.com.
- Národní centrum pro biotechnologické informace. (2017, 25. února). Složená databáze PubChem; CID = 16741146. Citováno z PubChem.
- Asociace dusičnanu draselného PNA. (2016). Dusičnan (NO3-) versus amonný (NH4 +). získaný z kno3.org.
- Royal Society of Chemistry. (2015). Amonný iont. Obnoveno z chemspider: chemspider.com.
- Sposito, G. (2011, 2. září). Půda. Obnoveno z encyklopedie britannica: britannica.com.
- ID testu: RAMBO amonné, náhodné, moč. (S.F.). Obnoveno z encyclopediamayomedicallaboratorie.com.
- Encyklopedie VIAS. (2004, 22. prosince). Amonné soli. Obnoveno z encyklopedie vias.org.



Zatím žádné komentáře