
Avogadrovy zákonné jednotky měření a experimentu
The Avogadrov zákon předpokládá, že stejný objem všech plynů, při stejné teplotě a tlaku, má stejný počet molekul. Amadeo Avogadro, italský fyzik, navrhl v roce 1811 dvě hypotézy: první říká, že atomy elementárních plynů jsou pohromadě v molekulách, místo aby existovaly jako samostatné atomy, jak řekl John Dalton..
Druhá hypotéza říká, že stejné objemy plynů při konstantním tlaku a teplotě mají stejný počet molekul. Avogadrova hypotéza týkající se počtu molekul v plynech byla přijata až v roce 1858, kdy italský chemik Stanislao Cannizaro na základě toho vytvořil logický systém chemie.

Z Avogadrova zákona lze odvodit následující: pro danou hmotnost ideálního plynu je jeho objem a počet molekul přímo úměrné, pokud jsou teplota a tlak konstantní. To také znamená, že molární objem plynů, které se chovají ideálně, je pro všechny stejný.
Například vzhledem k počtu balónků označených A až Z jsou všechny naplněny, dokud nejsou nafouknuty na objem 5 litrů. Každé písmeno odpovídá jinému plynnému druhu; to znamená, že jeho molekuly mají své vlastní vlastnosti. Avogadrův zákon stanoví, že všechny balóny obsahují stejný počet molekul.
Pokud jsou balónky nyní nafouknuty na 10 litrů, podle Avogadrových hypotéz bude zaveden dvojnásobný počet počátečních plynných molů.
Rejstřík článků
- 1 Z čeho se skládá a měrné jednotky
- 1.1 Odpočet hodnoty R, když je vyjádřena v L atm / K mol
- 2 Obvyklá forma Avogadrova zákona
- 3 Důsledky a důsledky
- 4 Počátky
- 4.1 Avogadrova hypotéza
- 4.2 Avogadrovo číslo
- 5 Avogadrov experiment
- 5.1 Experimentujte s komerčními kontejnery
- 6 příkladů
- 6,1 O2 + 2H2 => 2H2O
- 6,2 N2 + 3H2 => 2NH3
- 6,3 N2 + O2 => 2NO
- 7 Reference
Z čeho se skládá a jednotky měření
Avogadrův zákon stanoví, že u hmotnosti ideálního plynu je objem plynu a počet molů přímo úměrný, pokud jsou teplota a tlak konstantní. Matematicky to lze vyjádřit následující rovnicí:
V / n = K.
V = objem plynu, obecně vyjádřený v litrech.
n = množství látky měřené v molech.
Také z takzvaného zákona o ideálním plynu máme následující:
PV = nRT
P = tlak plynu je obvykle vyjádřen v atmosférách (atm), v mm rtuti (mmHg) nebo v Pascalech (Pa).
V = objem plynu vyjádřený v litrech (L).
n = počet krtků.
T = teplota plynu vyjádřená ve stupních Celsia, ve stupních Fahrenheita nebo ve stupních Kelvina (0 ° C se rovná 273,15 K).
R = univerzální konstanta ideálních plynů, kterou lze vyjádřit v různých jednotkách, z nichž vyniká: 0,08205 L atm / K. mol (L atm K-1.krtek-1); 8,144 J / K. mol (J.K.-1.krtek-1) (J je joule); a 1987 kal / Kmol (kal. K.-1.krtek-1) (cal jsou kalorie).
Odpočet hodnoty R, vyjádřeno v LAtm / K.Krtek
Objem, který zabírá plyn v atmosféře tlaku a 0 ° C, což odpovídá 273 K, je 22 414 litrů.
R = PV / T
R = 1 atm x 22 414 (L / mol) / (273 ° K)
R = 0,082 l atm / mol.K
Rovnici ideálního plynu (PV = nRT) lze napsat následovně:
V / n = RT / P
Pokud se předpokládá, že teplota a tlak jsou konstantní, protože R je konstanta, pak:
RT / P = K.
Později:
V / n = K.
To je důsledek Avogadrova zákona: existence konstantního vztahu mezi objemem, který zabírá ideální plyn, a počtem molů tohoto plynu pro konstantní teplotu a tlak..
Obvyklá forma Avogadrova zákona
Pokud máte dva plyny, stane se výše uvedená rovnice následující:
PROTI1/ n1= Vdva/ ndva
Tento výraz se také píše jako:
PROTI1/ Vdva= n1/ ndva
Výše uvedené ukazuje naznačený vztah proporcionality.
Avogadro ve své hypotéze poukázal na to, že dva ideální plyny ve stejném objemu a při stejné teplotě a tlaku obsahují stejný počet molekul.
V širším smyslu platí totéž pro skutečné plyny; například stejný objem Odva a Ndva obsahuje stejný počet molekul, když je při stejné teplotě a tlaku.
Skutečné plyny vykazují malé odchylky od ideálního chování. Avogadrův zákon však platí přibližně pro skutečné plyny při dostatečně nízkém tlaku a při vysokých teplotách.
Důsledky a důsledky
Nejvýznamnějším důsledkem Avogadrova zákona je, že konstanta R pro ideální plyny má stejnou hodnotu pro všechny plyny.
R = PV / nT
Pokud je tedy R konstantní pro dva plyny:
P1PROTI1/ nT1= PdvaPROTIdva/ ndvaTdva = konstantní
Přípony 1 a 2 představují dva různé ideální plyny. Závěrem je, že konstanta ideálního plynu pro 1 mol plynu je nezávislá na povaze plynu. Potom bude objem obsazený tímto množstvím plynu při dané teplotě a tlaku vždy stejný.
Důsledkem aplikace Avogadrova zákona je zjištění, že 1 mol plynu zaujímá objem 22 414 litrů při tlaku 1 atmosféry a při teplotě 0 ° C (273 K).
Dalším zjevným důsledkem je následující: jsou-li tlak a teplota konstantní, zvyšuje se při zvětšení množství plynu také jeho objem..
původ
V roce 1811 Avogadro předložil svou hypotézu založenou na Daltonově atomové teorii a Gay-Lussacově zákoně o vektorech pohybu molekul..
Gay-Lussac dospěl v roce 1809 k závěru, že „plyny v jakémkoli poměru je lze kombinovat, vždy vedou ke vzniku sloučenin, jejichž objemově měřené prvky jsou vždy násobky druhého“.
Stejný autor také ukázal, že „kombinace plynů vždy probíhají podle velmi jednoduchých objemových vztahů“.
Avogadro poukázal na to, že chemické reakce v plynné fázi zahrnují molekulární druhy reaktantů i produktu.
Podle tohoto tvrzení musí být vztah mezi molekulami reaktantu a produktu celé číslo, protože existence rozbití vazby před reakcí (jednotlivé atomy) není pravděpodobná. Molární množství však lze vyjádřit zlomkovými hodnotami.
Zákon kombinačních objemů naznačuje, že numerický vztah mezi plynnými objemy je také jednoduchý a celočíselný. To má za následek přímou souvislost mezi objemy a počtem molekul plynných druhů..
Avogadrova hypotéza
Avogadro navrhl, aby molekuly plynu byly diatomické. To vysvětluje, jak se dva objemy molekulárního vodíku spojují s jedním objemem molekulárního kyslíku za vzniku dvou objemů vody..
Avogadro dále navrhuje, aby pokud stejné objemy plynů obsahovaly stejný počet částic, vztah mezi hustotami plynů by měl být stejný jako vztah mezi molekulovými hmotnostmi těchto částic..
Je zřejmé, že dělení d1 na d2 vede ke kvocientu m1 / m2, protože objem obsazený plynnými hmotami je pro oba druhy stejný a je zrušen:
d1 / d2 = (m1 / V) / (m2 / V)
d1 / d2 = m1 / m2
Avogadro číslo
Jeden krtek obsahuje 6,022 x 102. 3 molekuly nebo atomy. Toto číslo se nazývá Avogadrovo číslo, i když to nebyl on, kdo to vypočítal. Jean Pierre, nositel Nobelovy ceny z roku 1926, provedl odpovídající měření a navrhl jméno na počest Avogadra.
Avogadrov experiment
Velmi jednoduchá ukázka Avogadrova zákona spočívá v umístění kyseliny octové do skleněné láhve a následném přidání hydrogenuhličitanu sodného, uzavření ústí láhve balónkem, který brání vstupu nebo výstupu plynu z láhve.
Kyselina octová reaguje s hydrogenuhličitanem sodným, čímž uvolňuje COdva. Plyn se hromadí v balónu a způsobuje jeho nafouknutí. Teoreticky je objem dosažený balónem úměrný počtu molekul COdva, jak stanoví Avogadrův zákon.
Tento experiment má však omezení: balón je elastické tělo; proto, jak se jeho stěna táhne v důsledku akumulace COdva, v tom je generována síla, která se staví proti jejímu roztažení a snaží se zmenšit objem balónu.
Experimentujte s komerčními kontejnery
Další ilustrativní experiment Avogadrova zákona je představen s použitím plechovek od sodovky a plastových lahví..
V případě plechovek se sodou se do ní nalije jedlá soda a poté se přidá roztok kyseliny citronové. Sloučeniny navzájem reagují a uvolňují plynný COdva, který se hromadí uvnitř plechovky.
Následně se přidá koncentrovaný roztok hydroxidu sodného, který má funkci "sekvestrace" CO.dva. Přístup dovnitř plechovky je poté rychle uzavřen pomocí maskovací pásky.
Po určité době se pozoruje, že plechovka se smršťuje, což naznačuje, že přítomnost CO poklesla.dva. Potom by se dalo předpokládat, že došlo ke snížení objemu plechovky, které odpovídá snížení počtu molekul CO.dva, podle Avogadrova zákona.
Při experimentu s lahví se postupuje stejně jako u sodovky, a když se přidá NaOH, ústí lahve se uzavře víkem; podobně je pozorováno smrštění stěny lahve. Ve výsledku lze provést stejnou analýzu jako v případě sodovky..
Příklady
Tři níže uvedené obrázky ilustrují koncept Avogadrova zákona týkajícího se objemu, který plyny zabírají, a počtu molekul reaktantů a produktů..
NEBOdva + 2Hdva => 2HdvaNEBO
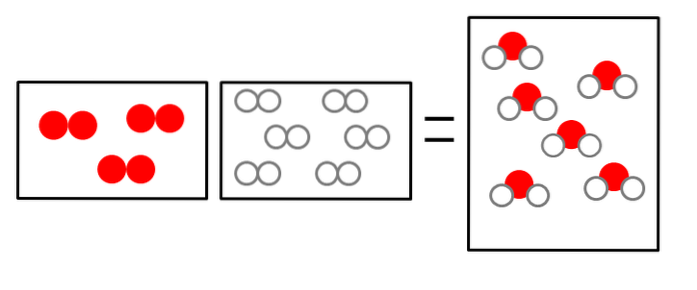
Objem plynného vodíku je dvojnásobný, ale zaujímá nádobu stejné velikosti jako plynný kyslík.
Ndva + 3Hdva => 2NH3
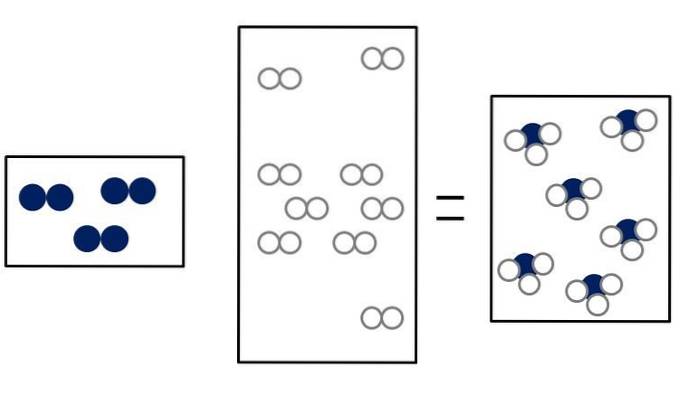
Ndva + NEBOdva => 2NO

Reference
- Bernard Fernandez, PhD. (Únor 2009). Dvě hypotézy Avogadra (1811). [PDF]. Převzato z: bibnum.education.fr
- Nuria Martínez Medina. (5. července 2012). Avogadro, velký italský vědec 19. století. Převzato z: rtve.es
- Muñoz R. a Bertomeu Sánchez J.R. (2003) Dějiny vědy v učebnicích: Avogadrova hypotéza, Teaching science, 21 (1), 147-161.
- Helmenstine, Anne Marie, Ph.D. (1. února 2018). Co je Avogadrův zákon? Převzato z: thoughtco.com
- Redaktoři Encyclopaedia Britannica. (2016, 26. října). Avogadrov zákon. Encyklopedie Britannica. Převzato z: britannica.com
- Yang, S. P. (2002). Výrobky pro domácnost se skládaly a uzavíraly kontejnery a demonstrovaly Avogadrův zákon. Chem. Pedagog. Svazek: 7, strany: 37-39.
- Glasstone, S. (1968). Smlouva o fyzikální chemii. dvadává Vyd. Redakční Aguilar.



Zatím žádné komentáře