
Henryho zákon rovnice, odchylka, aplikace
The Henryho zákon uvádí, že při konstantní teplotě je množství plynu rozpuštěného v kapalině přímo úměrné jeho parciálnímu tlaku na povrch kapaliny.
To bylo postulováno v roce 1803 anglickým fyzikem a chemikem Williamem Henrym. Jeho zákon lze také interpretovat takto: pokud se zvýší tlak na kapalinu, tím větší bude množství plynu v ní rozpuštěného..

Zde se plyn považuje za rozpuštěnou látku v roztoku. Na rozdíl od pevné látky má teplota nepříznivý vliv na její rozpustnost. Jak tedy teplota stoupá, plyn má tendenci snadněji unikat z kapaliny směrem k povrchu..
Je to proto, že zvýšení teploty přispívá energií k plynným molekulám, které se navzájem sráží a vytvářejí bubliny (horní obrázek). Tyto bubliny pak překonávají vnější tlak a unikají ze sinu kapaliny..
Pokud je vnější tlak velmi vysoký a kapalina je udržována chladná, bubliny se rozpustí a na povrchu se „vznáší“ jen několik plynných molekul..
Rejstřík článků
- 1 Henryho rovnice zákona
- 2 Odchylka
- 3 Rozpustnost plynu v kapalině
- 3.1 Nenasycené
- 3.2 Nasycené
- 3,3 přesycený
- 4 Aplikace
- 5 příkladů
- 6 Reference
Henryho rovnice zákona
Lze jej vyjádřit následující rovnicí:
P = K.H∙ C.
Kde P je parciální tlak rozpuštěného plynu; C je koncentrace plynu; a K.H je Henryho konstanta.
Je nutné si uvědomit, že parciální tlak plynu je tlak, který je vyvíjen jednotlivě druhem zbytku celkové směsi plynů. A celkový tlak není nic jiného než součet všech parciálních tlaků (Daltonův zákon):
PCelkový= P1 + Pdva + P3+… + Pn
Počet plynných druhů, které tvoří směs, představuje n. Například pokud je na povrchu kapaliny vodní pára a COdva, n se rovná 2.
Odchylka
U plynů špatně rozpustných v kapalinách je řešení téměř ideální, což odpovídá Henryho zákonu o rozpuštěné látce.
Když je však vysoký tlak, existuje odchylka od Henryho, protože řešení se přestane chovat jako ideální ředidlo.
Co to znamená? Že interakce solute-solute a solute-solvent začínají mít své vlastní účinky. Když je roztok velmi zředěný, jsou molekuly plynu „výlučně“ obklopeny rozpouštědlem, čímž se zanedbávají možná vzájemná setkání..
Proto, když řešení již není ideálně zředěné, je v grafu P pozorována ztráta lineárního chováníi vs X.i.
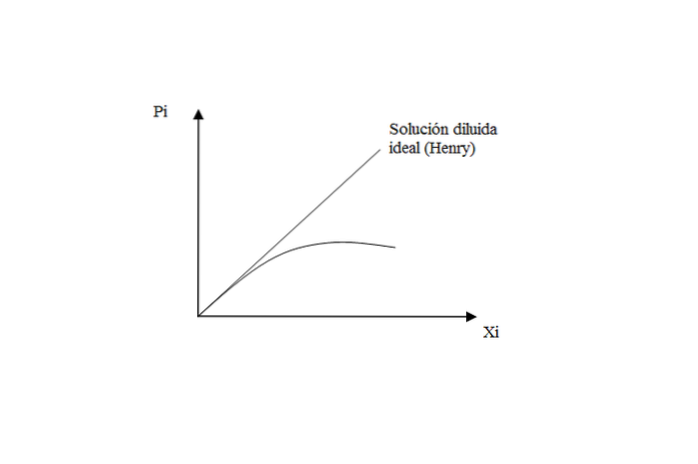
Na závěr tohoto aspektu: Henryho zákon určuje tlak par rozpuštěné látky v ideálním zředěném roztoku. Pokud jde o rozpouštědlo, platí Raoultův zákon:
PNA = XNA∙ PNA*
Rozpustnost plynu v kapalině

Když je plyn dobře rozpuštěn v kapalině, jako je cukr ve vodě, nelze jej odlišit od prostředí, čímž vznikne homogenní roztok. Jinými slovy: v kapalině (nebo krystalech cukru) nejsou pozorovány žádné bubliny.
Účinné solvatace plynných molekul však závisí na některých proměnných, jako jsou: teplota kapaliny, tlak, který ji ovlivňuje, a chemická podstata těchto molekul ve srovnání s kapalinou..
Pokud je vnější tlak příliš vysoký, zvyšuje se šance na průnik plynu na povrch kapaliny. A na druhé straně je pro rozpuštěné plynné molekuly obtížnější překonat dopadající tlak, aby unikly ven..
Pokud je systém kapalných plynů míchán (jak se vyskytuje v moři a ve vzduchových čerpadlech uvnitř nádrže na ryby), je upřednostňována absorpce plynu.
A jak ovlivňuje povaha rozpouštědla absorpci plynu? Pokud je polární, jako voda, bude vykazovat afinitu k polárním solutům, tj. K těm plynům, které mají stálý dipólový moment. I když je nepolární, jako jsou uhlovodíky nebo tuky, upřednostňuje nepolární plynné molekuly
Například amoniak (NH3) je velmi rozpustný plyn ve vodě v důsledku interakcí s vodíkovými vazbami. Zatímco vodík (Hdva), jehož malá molekula je nepolární, interaguje slabě s vodou.
V závislosti na stavu procesu absorpce plynu v kapalině lze v nich také stanovit následující stavy:
Nenasycený
Kapalina je nenasycená, když je schopna rozpustit více plynu. Je to proto, že vnější tlak je vyšší než vnitřní tlak kapaliny..
Nasycený
Kapalina vytváří rovnováhu v rozpustnosti plynu, což znamená, že plyn uniká stejnou rychlostí jako proniká do kapaliny..
Lze to vidět také následujícím způsobem: pokud tři plynné molekuly uniknou do vzduchu, další tři se vrátí do kapaliny současně.
Přesycený
Kapalina je přesycená plynem, pokud je její vnitřní tlak vyšší než vnější tlak. A s minimální změnou v systému uvolní přebytečný rozpuštěný plyn, dokud nebude obnovena rovnováha.
Aplikace
- K provedení absorpčních výpočtů inertních plynů (dusík, helium, argon atd.) V různých tkáních lidského těla lze použít Henryho zákon, který je společně s Haldanovou teorií základem tabulek dekomprese.
- Jednou důležitou aplikací je nasycení krevních plynů. Když je krev nenasycená, plyn se v ní rozpouští, dokud se nenasytí a přestane se dále rozpouštět. Jakmile k tomu dojde, plyn rozpuštěný v krvi projde do vzduchu..
- Zplyňování nealkoholických nápojů je příkladem aplikovaného Henryho zákona. Nealkoholické nápoje mají COdva rozpuštěna pod vysokým tlakem, čímž se udržuje každá z kombinovaných složek, které ji tvoří; a navíc zachovává charakteristickou chuť mnohem déle.
Když je lahvička sody uzavřená, tlak nad kapalinou klesá a tlak se okamžitě uvolní.
Protože tlak na kapalinu je nyní nižší, rozpustnost COdva sestupuje a uniká do prostředí (je vidět na vzestupu bublin ze dna).

- Když potápěč sestupuje do větších hloubek, inhalovaný dusík nemůže uniknout, protože mu brání vnější tlak, který se rozpouští v krvi jedince.
Když potápěč rychle stoupne na povrch, kde vnější tlak opět poklesne, začne do krve bublat dusík..
To způsobuje takzvanou dekompresní nemoc. Z tohoto důvodu se vyžaduje, aby potápěči stoupali pomalu, aby dusík z krve unikal pomaleji..
- Studium účinků poklesu molekulárního kyslíku (Odva) rozpuštěné v krvi a tkáních horolezců nebo praktikujících činností, které zahrnují dlouhodobý pobyt ve vysokých nadmořských výškách, stejně jako v obyvatelích poměrně vysokých míst.
- Výzkum a zdokonalování metod používaných k zabránění přírodním katastrofám, které mohou být způsobeny přítomností rozpuštěných plynů ve velkých vodních útvarech, které mohou být násilně uvolňovány.
Příklady
Henryho zákon platí pouze tehdy, když jsou molekuly v rovnováze. Zde jsou nějaké příklady:
- V rozpuštěném kyslíku (Odva) v krevní tekutině je tato molekula považována za špatně rozpustnou ve vodě, i když její rozpustnost je značně zvýšena vysokým obsahem hemoglobinu v ní. Každá molekula hemoglobinu se tedy může vázat na čtyři molekuly kyslíku, které se uvolňují v tkáních a používají se v metabolismu.
- V roce 1986 byl zaznamenán hustý mrak oxidu uhličitého, který byl najednou vyloučen z jezera Nyos (v Kamerunu) a dusil přibližně 1700 lidí a velké množství zvířat, což vysvětlil tento zákon.
- Rozpustnost, kterou se daný plyn projevuje v kapalných druzích, má sklon zvyšovat se zvyšujícím se tlakem uvedeného plynu, i když při vysokých tlacích existují určité výjimky, jako jsou molekuly dusíku (Ndva).
- Henryho zákon nelze použít, pokud dochází k chemické reakci mezi látkou, která působí jako rozpuštěná látka, a látkou, která působí jako rozpouštědlo; to je případ elektrolytů, jako je kyselina chlorovodíková (HCl).
Reference
- Crockford, H.D., Knight Samuel B. (1974). Základy fyzikálně-chemické. (6. vydání). Redakční C.E.C.S.A., Mexiko. P 111-119.
- Redaktoři Encyclopaedia Britannica. (2018). Henryho zákon. Citováno dne 10. května 2018 z webu: britannica.com
- Byju. (2018). Co je Henryho zákon? Citováno dne 10. května 2018 z: byjus.com
- Leisurepro a Aquaviews. (2018). Henryho zákon Citováno dne 10. května 2018 z: leisurepro.com
- Annenbergova nadace. (2017). Oddíl 7: Henryho zákon. Citováno dne 10. května 2018 z: learnner.org
- Monica Gonzalez. (25. dubna 2011). Henryho zákon. Citováno dne 10. května 2018 z: quimica.laguia2000.com
- Ian Myles. (24. července 2009). Potápěč. [Postava]. Citováno dne 10. května 2018 z: flickr.com



Zatím žádné komentáře