
Top 6 faktorů ovlivňujících rozpustnost
Hlavní faktory ovlivňující rozpustnost Jsou to polarita, společný iontový efekt, teplota, tlak, povaha rozpuštěné látky a mechanické faktory. Rozpustnost je schopnost pevné, kapalné nebo plynné chemikálie (nazývané rozpuštěná látka) rozpouštět se v rozpouštědle (obvykle kapalině) a tvořit roztok..
Rozpustnost látky závisí hlavně na použitém rozpouštědle, jakož i na teplotě a tlaku. Rozpustnost látky v konkrétním rozpouštědle se měří koncentrací nasyceného roztoku.

Roztok se považuje za nasycený, když přidání další rozpuštěné látky již nezvyšuje koncentraci roztoku..
Stupeň rozpustnosti se velmi liší v závislosti na látkách, od nekonečně rozpustných (zcela mísitelných), jako je ethanol ve vodě, až po mírně rozpustné, jako je chlorid stříbrný ve vodě. Termín „nerozpustný“ se často používá u špatně rozpustných sloučenin (Boundless, S.F.).
Některé látky jsou rozpustné ve všech poměrech s daným rozpouštědlem, jako je ethanol ve vodě, tato vlastnost je známá jako mísitelnost.
Za různých podmínek může být rovnovážná rozpustnost překročena za vzniku takzvaného přesyceného roztoku (Solubility, S.F.).
Hlavní faktory ovlivňující rozpustnost
1- Polarita
Ve většině případů se rozpuštěné látky rozpouštějí v rozpouštědlech, která mají podobnou polaritu. Chemici používají k popisu této vlastnosti rozpuštěných látek a rozpouštědel populární aforismus: „jako se rozpouští jako“.
Nepolární rozpuštěné látky se nerozpouštějí v polárních rozpouštědlech a naopak (Educating online, S.F.).
2- Účinek společného iontu
Běžným iontovým účinkem je termín, který popisuje pokles rozpustnosti iontové sloučeniny, když se do směsi přidá sůl obsahující ion, který již existuje v chemické rovnováze..
Tento efekt nejlépe vysvětluje Le Châtelierův princip. Představte si, že je mírně rozpustná iontová sloučenina síran vápenatý, CaSO4, se přidá do vody. Čistá iontová rovnice pro výslednou chemickou rovnováhu je následující:
CaSO4 (s) ⇌Ca2 + (aq) + SO42− (aq)
Síran vápenatý je málo rozpustný. V rovnováze většina vápníku a síranu existuje v pevné formě síranu vápenatého..
Předpokládejme, že rozpustná iontová sloučenina síran měďnatý (CuSO4) byl přidán k roztoku. Síran měďnatý je rozpustný; Jediným hlavním účinkem na čistou iontovou rovnici je proto přidání více síranových iontů (SO4dva-).
CuSO4 (s) ⇌Cu2 + (aq) + SO42− (aq)
Sulfátové ionty disociované ze síranu měďnatého jsou již ve směsi přítomny (společné) z mírné disociace síranu vápenatého.
Proto toto přidání síranových iontů zdůrazňuje dříve stanovenou rovnováhu.
Princip Le Chatelier diktuje, že dodatečné napětí na této straně rovnovážného produktu vede k rovnovážnému posunu směrem ke straně reaktantů, aby se tento nový stres uvolnil..
V důsledku posunu na stranu reaktantů se rozpustnost mírně rozpustného síranu vápenatého dále snižuje (Erica Tran, 2016)..
3 - Teplota
Teplota má přímý vliv na rozpustnost. U většiny iontových pevných látek se zvyšováním teploty zvyšuje, jak rychle lze roztok připravit.
Jak teplota stoupá, částice pevné látky se pohybují rychleji, což zvyšuje pravděpodobnost, že budou interagovat s více částicemi rozpouštědla. To má za následek zvýšení rychlosti, jakou je řešení vyráběno..
Teplota může také zvýšit množství rozpuštěné látky, kterou lze rozpustit v rozpouštědle. Obecně řečeno, jak se teplota zvyšuje, rozpouští se více rozpuštěných částic.
Například přidání stolního cukru do vody je snadný způsob výroby řešení. Když se tento roztok zahřeje a přidá se cukr, zjistí se, že lze přidávat velké množství cukru, jak se teplota stále zvyšuje..
Důvodem je to, že jak teplota stoupá, mohou se mezimolekulární síly snáze rozbíjet, což umožňuje přitahovat k částicím rozpouštědla více rozpuštěných částic..
Existují však i jiné příklady, kdy zvýšení teploty má velmi malý vliv na to, kolik rozpustné látky lze rozpustit..
Dobrým příkladem je kuchyňská sůl: v ledové vodě můžete rozpustit téměř stejné množství kuchyňské soli jako ve vroucí vodě..
Jak teplota stoupá, rozpustnost klesá pro všechny plyny. K vysvětlení tohoto jevu lze použít kinetickou molekulární teorii..
Jak teplota stoupá, molekuly plynu se pohybují rychleji a jsou schopny uniknout z kapaliny. Rozpustnost plynu tedy klesá.
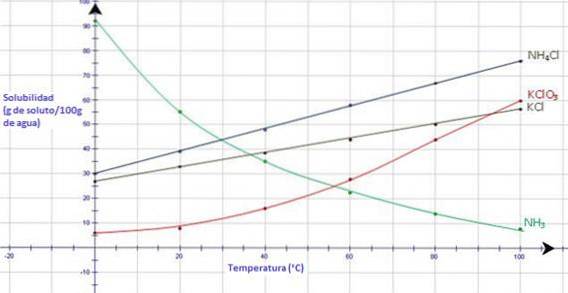
Při pohledu na níže uvedený graf ukazuje plynný amoniak, NH3, silné snížení rozpustnosti při zvyšování teploty, zatímco všechny iontové pevné látky vykazují zvyšování rozpustnosti při zvyšování teploty (CK-12 Foundation, S.F.).
4 - Tlak
Druhý faktor, tlak, ovlivňuje rozpustnost plynu v kapalině, ale nikdy ne pevné látky, která se v kapalině rozpouští..
Když je aplikován tlak na plyn, který je nad povrchem rozpouštědla, plyn se bude pohybovat do rozpouštědla a zabírat některé z prostorů mezi částicemi rozpouštědla..
Dobrým příkladem je perlivá soda. Tlak je aplikován, aby vtlačil molekuly CO2 do sody. Opak je také pravdou. Když tlak plynu klesá, snižuje se také rozpustnost tohoto plynu.
Když je otevřena plechovka na sodovku, tlak v sodě klesá, takže plyn okamžitě začíná vytékat z roztoku.
Oxid uhličitý uložený v sodě se uvolňuje a na povrchu kapaliny můžete vidět šumění. Pokud po určitou dobu necháte otevřenou plechovku sody, můžete si všimnout, že se nápoj stane plochým kvůli ztrátě oxidu uhličitého..
Tento faktor tlaku plynu je vyjádřen Henryho zákonem. Henryho zákon stanoví, že při dané teplotě je rozpustnost plynu v kapalině úměrná parciálnímu tlaku plynu nad kapalinou.
Příkladem Henryho zákona je potápění. Když se člověk ponoří do hluboké vody, zvyšuje se tlak a v krvi se rozpouští více plynů.
Při stoupání z ponoru v hluboké vodě se potápěč musí vrátit na hladinu vody velmi pomalou rychlostí, aby umožnil všem rozpuštěným plynům velmi pomalu opustit krev.
Pokud osoba vystoupá příliš rychle, může nastat lékařská pohotovost kvůli příliš rychlému opouštění plynů z krve (Papapodcasts, 2010).
5 - Povaha rozpuštěné látky
Rozpustnost ovlivňuje povaha rozpuštěné látky a rozpouštědla a přítomnost dalších chemických sloučenin v roztoku..
Například ve vodě lze rozpustit více cukru než soli ve vodě. V tomto případě se říká, že cukr je rozpustnější.
Ethanol ve vodě jsou navzájem zcela rozpustné. V tomto konkrétním případě bude rozpouštědlem sloučenina nalezená v největším množství.
Důležitým faktorem je také velikost rozpuštěné látky. Čím větší jsou molekuly rozpuštěné látky, tím větší je její molekulová hmotnost a velikost. Pro molekuly rozpouštědla je obtížnější obklopit větší molekuly.
Pokud jsou vyloučeny všechny výše uvedené faktory, lze zjistit obecné pravidlo, že větší částice jsou obecně méně rozpustné..
Pokud jsou tlak a teplota stejné jako mezi dvěma rozpuštěnými látkami se stejnou polaritou, je ten s menšími částicemi obvykle rozpustnější (faktory ovlivňující rozpustnost, S.F.).
6- Mechanické faktory
Na rozdíl od rychlosti rozpouštění, která závisí hlavně na teplotě, rychlost rekrystalizace závisí na koncentraci rozpuštěné látky na povrchu krystalové mřížky, která je upřednostňována, když je roztok nepohyblivý.
Proto míchání roztoku zabraňuje této akumulaci a maximalizuje rozpuštění. (tipy nasycení, 2014).
Reference
- (S.F.). Rozpustnost. Obnoveno z boundles.com.
- Nadace CK-12. (S.F.). Faktory ovlivňující rozpustnost. Obnoveno z ck12.org.
- Vzdělávání online. (S.F.). Faktory ovlivňující rozpustnost. Obnoveno z solubilityofthings.com.
- Erica Tran, D. L. (2016, 28. listopadu). Rozpustnost a faktory ovlivňující rozpustnost. Obnoveno z chem.libretexts.org.
- Faktory ovlivňující rozpustnost. (S.F.). Obnoveno z sciencesource.pearsoncanada.ca.
- (2010, 1. března). Faktory ovlivňující rozpustnost Část 4. Obnoveno z youtube.com.
- Rozpustnost. (S.F.). Obnoveno z chemed.chem.purdue.ed.
- špičky sytosti. (2014, 26. června). Obnoveno z chemie libretex.org.


Zatím žádné komentáře